2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
4. 浙江省海洋水产研究所 浙江省海水增养殖重点实验室 浙江 舟山 316021
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao, Shandong 266071, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266237, China;
4. Zhejiang Province Key Laboratory of Mariculture and Enhancement, Marine Fisheries Research Institute of Zhejiang, Zhoushan, Zhejiang 316021, China
染色体是生物遗传信息的载体,是两性生物进化、遗传变异的物质基础,研究染色体数目和核型,对了解生物遗传变异规律、亲缘关系、进化地位、性别决定机制等均具有重要意义(史宝等, 2017; Amores et al, 2014)。同时,可为生物的种质鉴定、雌(雄)核发育、多倍体诱导、杂交育种等技术的研究以及染色体水平的基因组组装提供参考依据(Molina-Luzón et al, 2015)。现存的头足类大约有700余种,但对其染色体核型的研究相对较少。目前,国内外仅对10种头足类的染色体进行了研究:金乌贼(Sepia esculenta)、虎斑乌贼(Sepia pharaonis)、拟目乌贼(Sepia lycidas)、莱氏拟乌贼(Sepioteuthis lessoniana)、长枪乌贼(Heterololigo bleekeri)、剑尖枪乌贼(Photololigo edulis)、商乌贼(Sepia officenalis)、短蛸(Octopus ocellatus)、长蛸(Octopus minor)和真蛸(王晓华等, 2011; Papan et al, 2010; Gao et al, 1990; Vitturi et al, 1982; Inaba, 1959)。目前,国内外对O. sinensis的研究主要集中在分类、发育生物学以及人工养殖技术等方面,对其染色体核型的研究未见报道(Amor et al, 2017、2019; Gleadall, 2016; Dan et al, 2019)。本研究对O. sinensis的染色体核型进行分析,旨在丰富其细胞遗传学数据,以期为其种质鉴定、资源保护和人工养殖等研究提供理论基础。
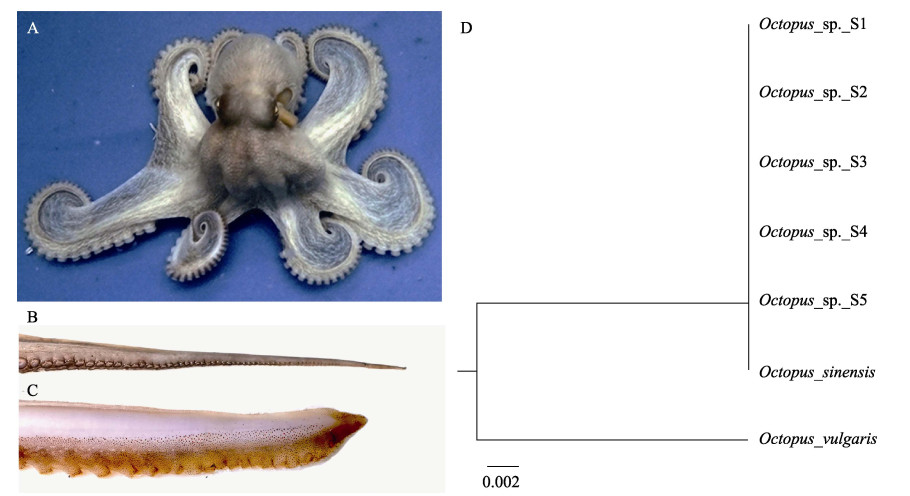
1 材料与方法 1.1 实验材料实验用真蛸为2019年10月在浙江省舟山市附近海域捕获的野生群体幼体,根据右侧第3腕足确定其雌雄(图 1B、C),雌雄各5只,雌性体重为(169.25±4.03) g,全长为(34.05±3.46) cm,生殖腺指数为1.31±0.62;雄性体重为(345.60±5.32) g,全长为(41.20±4.35) cm,性腺指数为2.31±0.89。按照Amor等(2017)的研究,基于线粒体COI基因部分序列对随机选取的5只章鱼进行分子生物学鉴定,鉴定结果为O. sinensis (图 1D)。实验在浙江省舟山市浙江省海洋水产研究所试验基地进行。实验开始前,车间暂养30 d,暂养水温为22℃~24℃,盐度为30~33,pH为7.8~8.4,DO > 6 mg/L。饲以菲律宾蛤仔(Ruditapes philippinarum)和日本蟳(Charybdis japonica),日投饵1次,投饵量为体重的5%~10%,采用流水养殖,日换水量为100%~200%。
|
图 1 O. sinensis外部形态及分子生物学鉴定 Fig.1 External morphology and molecular identification of the O. sinensis A:O. sinensis;B:雌性右侧第3腕足;C:雄性右侧第3腕足;D:基于线粒体COI基因部分序列的系统发育树。O. sinensis 和真蛸COI基因序列为从NCBI下载,序列号分别为NC006353和KF844029;Octopus sp. S1~S5为本研究所用章鱼 A: O. sinensis; B: The third right arm of female O. sinensis; C: The third right arm of male O.sinensis; D: the phylogenetic tree constructed based on partial sequence of the mitochondrial COI gene. The COI gene sequences of O. sinensis and O. vulgaris were downloaded from NCBI with accession number NC006353 and KF844029, respectively. Octopus sp. S1~S5 was the octopuses used in this study |
染色体标本制备参照金乌贼染色体核型分析方法(王晓华等, 2011),略作修改。预处理:将O. sinensis活体置于含秋水仙素终浓度为0.005%的过滤海水中暂养2 h,暂养水温为22℃~24℃,暂养过程中持续充气。处理:解剖并取鳃和肾脏组织于过滤海水配制的秋水仙素溶液(终浓度为0.04%)中浸泡30 min。低渗:将处理后的鳃和肾脏组织切成小块,并置于50 ml浓度为0.075 mol/l的KCl溶液中(蒸馏水配制)处理50 min。固定:将低渗后的组织转移至预冷的卡诺氏液(甲醇∶冰醋酸=3∶1)中,每隔15 min更换固定液,重复3次。固定后的组织4℃保存过夜。解离:固定后的组织于50%的冰醋酸(蒸馏水配制)中解离,解离时间视组织解离状态而定,待解离组织近乎透明,终止解离,剔除未解离的组织,并用吸管轻轻吹打解离液2 min。滴片:采用热滴片法制备染色体标本。染色:载玻片在空气中自燃干燥后,用10%的吉姆萨染液染色30 min,蒸馏水冲洗,晾干后镜检。整个实验过程雌雄各重复5次。
1.3 染色体核型分析使用Nikon ECLIPSE 80i显微镜对O. sinensis染色体标本进行观察并拍照。选取200个染色体分散较好的中期分裂相进行数目统计。再从中选取20个着色较好、轮廓清晰、收缩适中的染色体中期分裂相经放大打印后进行测量和分析,并计算相对长度和臂比。相对长度=(实测染色体长度/全部染色体长度总和)×100;臂比=长臂长度/短臂长度;按照Levan等(1964)提出的标准进行核型分析,按臂比将染色体分为4种类型:中部着丝点染色体(m,臂比1.00~1.70)、亚中部着丝点染色体(sm,臂比1.71~3.00)、亚端部着丝点染色体(st,臂比3.01~7.00)、端部着丝点染色体(t,臂比≥7.0)。中部着丝粒染色体(m)和亚中部着丝粒染色体(sm)臂数为2,亚端部着丝粒染色体(st)和端部着丝粒染色体(t)臂数为1。
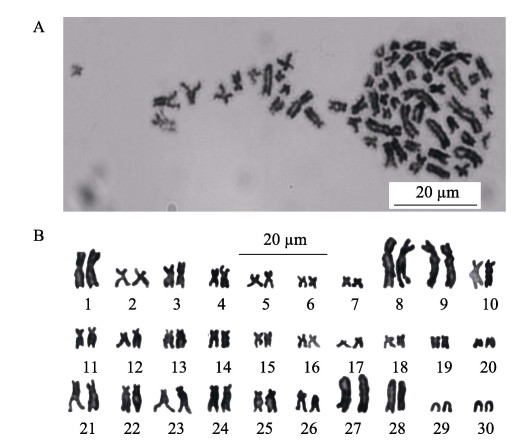
2 结果与分析 2.1 染色体数目的确定利用O. sinensis的鳃和肾脏组织均能获得中期分裂相(图 2A),雌雄各选取100个分散较好的分裂相进行数目统计(表 1)。统计结果显示,200个分裂相中,染色体条数为60的分裂相有156个,占比为78%,由此确定O. sinensis的二倍体染色体条数为2n=60。
|
图 2 O. sinensis中期分裂相染色体及核型 Fig.2 Metaphase chromosome and karyotype of O. sinensis A:O. sinensis中期分裂相染色体;B:O. sinensis染色体核型 A: Mataphase chromosomes of O. sinensis; B: Karyotype of O. sinensis |
|
|
表 1 O. sinensis二倍体染色体数目频率分布 Tab.1 Frequency distribution of O. sinensis diploid chromosome number |
染色体相对长度和臂比统计结果见表 2。根据相对长度和臂比,O. sinensis的60条染色体可配对为30对(图 2B),其中,7对为中部着丝粒染色体(m),13对为亚中部着丝粒染色体(sm),6对为亚端部着丝粒染色体(st),4对为端部着丝粒染色体(t)。最长和最短的染色体相对长度分别为3.76±0.05和0.70±0.13,均为亚中部着丝粒染色体。雌雄染色体类型一致,未发现性别相关的异型染色体,也没发现次溢痕和随体。确定本研究O. sinensis的染色体核型为2n=14 m+ 26 sm+12 st+8 t,臂数(NF)为100。
|
|
表 2 O. sinensis中期染色体类型、相对长度和臂比值(平均值±标准差) Tab.2 Relative length and arm ratio of metaphase chromosome in O. sinensis (Mean±SD) |
现存头足类有700余种,但仅有7种报道了染色体核型(表 3)。头足类染色体的研究最早见于Inaba (1959)的报道,采用精原细胞和初级精母细胞对长蛸和真蛸的染色体进行制备并分析染色体数目,并未报道核型。染色体标本多采用生物细胞分裂能力较强时期或组织进行制备,像鱼类的头肾、鳃等,细胞分裂指数高,更易获得较多的中期分裂相。已知头足类染色体核型的研究多采用性细胞、受精卵、正在发育的胚胎等(王晓华等, 2011; Papan et al, 2010; Gao et al, 1990; Vitturi et al, 1982; Inaba, 1959)。性腺和受精卵能够获得中期分裂相,但制备过程中细胞极易破裂,容易造成染色体丢失,同时,受精卵因含有较多的卵黄组织,会影响染色体分散及染色(王晓华等, 2011; Vitturi et al, 1982; Inaba, 1959)。正在发育的胚胎细胞分裂旺盛,所制备的染色体标本中期分裂相较多,染色体分散好,轮廓清晰,极适用于头足类染色体标本的制备(王晓华等, 2011)。在胚胎时期,头足类性别尚未分化,难以确定头足类的染色体性别决定机制。本研究利用O. sinensis幼体鳃和肾脏组织,采用活体浸泡秋水仙素暂养的方法,成功获得雌雄个体分散较好、轮廓清晰、收缩适中的染色体中期分裂相(图 2A)。首先,O. sinensis幼体处于生长期,细胞分裂相对旺盛,且已出现性别分化,有利于结合染色体核型分析其染色体性别决定机制。其次,采用含秋水仙素海水暂养的方法对活体进行预处理,保证在组织细胞活性下获得实验样本,提高有丝分裂指数。但与胚胎相比,幼体鳃和肾脏有丝分裂指数相对较低,可通过多次重复实验来弥补不足。
|
|
表 3 国内外头足类染色体核型研究 Tab.3 Study on karyotype of chromosome of cephalopod |
两性分化与有性生殖推动了生物的遗传和变异过程。异形染色体(性染色体)对在生物性别决定过程中发挥重要作用。根据异形染色体对在两性中的存在形式,可将目前已知的生物染色体决定模式分为XX/XY型、ZW/ZZ型、ZO/ZZ和XX/XO型以及复性染色体型(尚晓莉等, 2010)。部分生物的性别决定模式除受到性染色体调控外,常染色体也发挥一定的调控作用,即常染色体性别决定类型(童金苟等, 2003)。常染色体性别决定类型是指在现有的技术条件下未能发现异形染色体(尚晓莉等, 2010)。目前,国内外对软体动物染色体性别决定机制的研究较少,国内仅见栉江珧(Atrina pectinata)。周丽青等(2018)利用愈伤组织制备栉江珧染色体标本,分析发现栉江珧的染色体性别决定机制为XX/XY型。国外研究发现,在腹足类中可能存在XO或XY型性染色体(陈宇,2007)。国内外未见头足类染色体存在异形染色体的报道。本研究通过分析O. sinensis雌雄个体染色体核型亦未发现异形染色体,推断头足类染色体性别决定模式可能为常染色体性别决定类型。Twyman(2002)认为,大部分雌雄异体型动物原始性别及第二性征是由性染色体决定的。蛸类外部形态已出现雌雄性别的差异,即第二性征,具体表现为雄性右侧第3腕足特化为交接腕(图 1B、C)。因而,O. sinensis是否存在性染色体有待通过优化实验条件,染色体带型分析等方法进一步探究。
表 3显示,在蛸科中,Gao等(1990)报道的真蛸(O. vulgaris)二倍体染色体条数为60条,与Vitturi等(1982)和Inaba (1959)的研究结果(56条)存在差异。Gao等(1990)认为产生该种差异的原因为不同地理群体的生物存在染色体的种内变异。鉴于本研究O. sinensis的染色体条数也为60条,作者认为产生上述差异的原因更可能为染色体制备方法的差异。研究表明,取样材料对头足类染色体制备的影响较大(王晓华等, 2011)。本研究发现,O. sinensis性腺细胞在染色体制备过程中极易破裂,容易造成染色体的丢失。在乌贼科中,Gao等(1990)与王晓华等(2011)对金乌贼染色体核型分析所得的染色体条数一致(均为92条),但染色体核型有差异,主要体现在中部着丝粒染色体、亚中部着丝粒染色体和亚端部着丝粒染色体数目上的差异。该差异的产生可能有2个原因:1) 实验方法不同导致染色体收缩程度不同,进而影响到测量结果;研究显示,秋水仙素浓度过大或处理时间过长均会导致染色体收缩严重,进而影响到测量结果和后期染色体分型(梁述章等, 2019);2) 鱼类中不同地理群体的个体存在染色体多态性现象(Ren et al, 2014),头足类也可能存在类似现象。
染色体是生物遗传信息的载体,染色体的核型能够反映物种的进化历史和种间亲缘关系的远近(Vitturi et al, 1982)。乌贼科的金乌贼和拟目乌贼与枪乌贼科的长枪乌贼、剑尖枪乌贼和莱氏拟乌贼的二倍体染色体条数均为92条,而蛸科的O. sinensis、短蛸和真蛸为60条,说明乌贼科与枪乌贼科的亲缘关系可能更近,而与蛸科的亲缘关系较远。本研究O. sinensis的染色体核型为2n=14 m+26 sm+12 st+8 t,与真蛸(O. vulgaris)(2n=14 m+2 sm+8 st+36 t)相比,O. sinensis的染色体核型主要由中部着丝粒染色体和亚中部着丝粒染色体构成,说明O. sinensis的染色体核型更为稳定(Ahmed, 1976),染色体核型的差异也为二者的区分提供了另一个判定依据。短蛸(O. ocellatus)的染色体核型为2n=32 m+28 sm,不存在亚端部和端部着丝粒染色体,说明在蛸类进化过程中,染色体可能存在易位或倒置现象(Gao et al, 1990)。从染色体核型特征上可以看出,O. sinensis与真蛸(O. vulgaris)的亲缘关系更近,而与短蛸(O. ocellatus)的较远。头足纲是软体动物门中最高等的类群,其染色体条数(48~104)比其他软体动物(18~70)多(Vitturi et al, 1982; 王梅林等, 2000; 孙振兴, 2004),结果支持Patterson (1978)的推断:越原始的软体动物,染色体条数越少。在蛸科、乌贼科和枪乌贼科中,蛸科的染色体条数最少,推断蛸科的进化地位更为原始。
AMOR M D, DOYLE S R, NORMAN M D, et al. Genome-wide sequencing uncovers cryptic diversity and mitonuclear discordance in the Octopus vulgaris species complex. bioRxiv, 2019 DOI:10.1101/573493 |
AMOR M D, NORMAN M D, ROURA A, et al. Morphological assessment of the Octopus vulgaris species complex evaluated in light of molecular-based phylogenetic inferences. Zoologica Scripta, 2017, 46(3): 275-288 DOI:10.1111/zsc.12207 |
AMORES A A, CATCHEN J, NANDA I, et al. A RAD-tag genetic map for the platyfish (Xiphophorus maculatus) reveals mechanisms of karyotype evolution among teleost fish. Genetics, 2014, 197(2): 625-641 DOI:10.1534/genetics.114.164293 |
CHEN Y. The study on cytology of Lamprotula fibrosa. Masterxs Thesis of Huazhong Agricultural University, 2007 [陈宇. 绢丝丽蚌细胞学研究. 华中农业大学硕士研究生学位论文, 2007]
|
DAN S, IWASAKI H, TAKASUGI A, et al. Effects of co-supply ratios of swimming crab Portunus trituberculatus zoeae and Artemia on survival and growth of East Asian common octopus Octopus sinensis paralarvae under an upwelling culture system. Aquaculture Research, 2019, 50(4): 1361-1370 DOI:10.1111/are.14013 |
GAO Y M, NATSUKARI Y. Karyological studies on seven cephalopods. Venus, 1990, 49(2): 126-145 |
GLEADALL I G. Octopus sinensis d'Orbigny, 1841 (Cephalopoda: Octopodidae): Valid species name for the commercially valuable East Asian common octopus. Species Diversity, 2016, 21(1): 31-42 DOI:10.12782/sd.21.1.031 |
IGLESIAS J, SÁNCHEZ F J, BERSANO J G F, et al. Rearing of Octopus vulgaris paralarvae: Present status, bottlenecks and trends. Aquaculture, 2007, 266(1-4): 1-15 DOI:10.1016/j.aquaculture.2007.02.019 |
INABA A. Notes on the chromosomes of two species of octopods (Cephalopoda, Mollusca). Japanese Journal of Genetics, 1959, 34: 137-139 DOI:10.1266/jjg.34.137 |
LEVAN A, FREDGA K, SANDBERG A. Nomenclature for centromeric position on chromosomes. Hereditas, 1964, 52(2): 201-220 |
LIANG S Z, SONG W, JIANG K J, et al. Karyotype analysis of Collichthys lucidus. Progress in Fishery Sciences, 2019, 40(4): 172-177 [梁述章, 宋炜, 蒋科技, 等. 棘头梅童鱼染色体核型分析. 渔业科学进展, 2019, 40(4): 172-177] |
LIAO Y Y. Effect of production and consumption of octopus and cephalopoda on aquaculture of octopus. Modern Fisheries Information, 2006(6): 3-6 [廖永岩. 章鱼(Octopus)及头足类(Caphalopoda)的生产和消费对章鱼养殖的影响. 现代渔业信息, 2006(6): 3-6 DOI:10.3969/j.issn.1004-8340.2006.06.001] |
MOLINA-LUZÓN M J, LÓPEZ J R, ROBLES F. Chromosomal manipulation in Senegalese sole (Solea senegalensis Kaup, 1858): Induction of triploidy and gynogenesis. Journal of Applied Genetics, 2015, 56(1): 77-84 DOI:10.1007/s13353-014-0233-x |
OKUMURA S, KURIHARA A, IWAMOTO A, et al. Improved survival and growth in Octopus vulgaris paralarvae by feeding large type Artemia and Pacific sand eel, Ammodytes personatus: Improved survival and growth of common octopus paralarvae. Aquaculture, 2005, 244(1): 147-157 |
PAPAN F, JAZAYERI A, EBRAHIMIPOUR M. The study of Persian gulf cuttlefish (Sepia pharaonis) chromosome via incubation of blood cells. Journal of American Science, 2010, 6(2): 162-164 |
PATTERNSON C M. Chromosomes of pulmonate molluscs. Pulmonates 2A: Systematics, Evolution and Ecology, 1978, 171: 540 |
REN X, YU X. Characterization of nucleolar organizer regions of twelve species of Chinese cyprinid fishes. Caryologia, 2014, 46(2-3): 201-207 |
SHANG X L, QU X C. Advances in the mechanisms of sex determination and sex differentiation in fishes. Jiangsu Agricultural Sciences, 2010(4): 245-248 [尚晓莉, 曲宪成. 鱼类性别决定和性别分化机制研究进展. 江苏农业科学, 2010(4): 245-248 DOI:10.3969/j.issn.1002-1302.2010.04.099] |
SHI B, LIU Y S, LIU X Z, et al. Study on the karyotype of yellowtail kingfish (Seriola aureovittata). Progress in Fishery Sciences, 2017, 38(1): 136-141 |
史宝, 刘永山, 柳学周, 等. 黄条  染色体核型分析. 渔业科学进展, 2017, 38(1): 136-141 染色体核型分析. 渔业科学进展, 2017, 38(1): 136-141 |
SUN Z X. Progress on the chromosome study of marine mollusks in China. Marine Science Bulletin, 2004, 23(6): 77-83 [孙振兴. 中国海洋贝类染色体研究进展. 海洋通报, 2004, 23(6): 77-83 DOI:10.3969/j.issn.1001-6392.2004.06.013] |
TONG J G, ZHU J H, GUAN H S. A mini-review of studies on genetic basis of sex determination in fish. Journal of Fisheries of China, 2003, 27(2): 169-176 [童金苟, 朱嘉濠, 关海山. 鱼类性别决定的遗传基础研究概况. 水产学报, 2003, 27(2): 169-176] |
TWYMAN R M. Instant notes in developmental biology. Molecular Biotechnology Unit. John Innes Centre, Norwich, UK. Bios Scientific Publishers Limited, 2002, 151-159
|
VITTURI R, RASOTTO M B, FARINELLA-FERRUZZA N. The chromosomes of 16 molluscan species. Bollettino di Zoologia, 1982, 49: 61-71 DOI:10.1080/11250008209439373 |
WANG M L, ZHENG J S, ZHU L Y, et al. Advances on karyotype study of marine fish and shellfish in China. Journal of Ocean University of Qingdao (Natural Science), 2000, 30(2): 277-284 [王梅林, 郑家声, 朱丽岩, 等. 我国海洋鱼类和贝类染色体组型研究进展. 青岛海洋大学学报(自然科学版), 2000, 30(2): 277-284 DOI:10.3969/j.issn.1672-5174.2000.02.029] |
WANG X H, WU B, LI Q, et al. Karyotype analysis of golden cuttlefish Sepia esculenta. Chinese Journal of Zoology, 2011, 46(2): 77-81 [王晓华, 吴彪, 李琪, 等. 金乌贼染色体核型分析. 动物学杂志, 2011, 46(2): 77-81] |
WARNKE K, SOLLER R, BLOHM D, et al. A new look at geographic and phylogenetic relationships within the species group surrounding Octopus vulgaris (Mollusca, Cephalopoda): Indications of very wide distribution from mitochondrial DNA sequences. Journal of Zoological Systematics and Evolutionary Research, 2004, 42(4): 306-312 DOI:10.1111/j.1439-0469.2004.00277.x |
XU D F, LIU Y S, CHANG Q, et al. Morphology, growth and development in the early life of Octopus vulgaris. Progress in Fishery Sciences, 2019, 40(5): 145-154 [徐大凤, 刘永胜, 常青, 等. 真蛸早期发育形态特征及生长规律研究. 渔业科学进展, 2019, 40(5): 145-154] |
YE S J, ZHOU J W, YANG M X, et al. Exploitation of cephalopod resources in the world and development suggestion. Fishery Information and Strategy, 2014, 29(1): 11-17 [叶守建, 周劲望, 杨铭霞, 等. 全球头足类资源开发现状分析及发展建议. 渔业信息与战略, 2014, 29(1): 11-17 DOI:10.3969/j.issn.1004-8340.2014.01.003] |



