2. 中国水产科学研究院东海水产研究所 上海 200090
2. East China Sea Fisheries Research Institute, Shanghai 200090, China
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是由2个及2个以上的苯环以稠环或非稠环的形式相互连接成的有机化合物,其主要通过高分子有机化合物的不完全燃烧而产生(贾双琳等, 2020)。研究证明,PAHs具有致癌性、致突变性和致畸性,可以通过食物链作用在生物体内累积,对环境造成严重污染的同时,也对人类的健康产生危害(杨帆等, 2013; Zheng et al, 2016; Yin et al, 2017)。
16种优控多环芳烃一直受到广泛关注,其中,菲(phenanthrene, PHE)是具有代表性的低分子量多环芳烃,是水生生态系统中含量最丰富的一种(Shirmohammadi et al, 2017),通常作为研究PAHs的模型(Rabodonirina et al, 2019; Sun et al, 2019a)。PHE的化学结构稳定,有较强的疏水性,常吸附在水中的沉积物和悬浮颗粒上,在水体中可长距离迁移(Gu et al, 2016)。PHE对水生动物包括贝类、鱼类、水生昆虫等都具有潜在的毒性(武江越等, 2018)。李磊等(2015)、Yakan等(2013)、Mokkongpai等(2010)和Keshavarzifard等(2017)分别研究了PHE在缢蛏(Sinonovacula constricta)、地中海贻贝(Mytilus galloprovincialis)、青口贝(Perna viridis)、短颈蛤(Paphia undulata)等体内的富集动力学特征,均表明PHE在贝类体内有较强的富集能力,但关于比较单一多环芳烃在贝类不同组织富集及释放的特性和差异性的研究不多。PHE对水生生物基因表达也会产生影响,Peng等(2019)研究发现,PHE对斑马鱼(Barchydanio rerio var)雌鱼下丘脑–垂体–性腺轴的GnRH2和CYP11A1等基因的转录造成了明显的特异性改变,对斑马鱼繁殖造成不利的影响。Piazza等(2016)研究发现,圆吻扇贝(Nodipecten nodosus)暴露在PHE水溶液中,其体内CYP2UI、CYP2D20和CYP3A11等基因的转录水平增加。Karami等(2016)将非洲鲶(Glarias gariepinus)幼仔三倍体暴露于76 mg/L PHE浓度水溶液中;结果显示,鱼体fushi tarazu-factor 1(ftz-f1)的mRNA水平增加。热休克蛋白(heat shock proteins, HSPs)是一类应激蛋白,其中,HSP70是研究比较深入的一种HSPs,参与到各种保护机体和细胞机制中,通常作为环境应激和毒性的生物标志物(许高鹏等, 2015; Mayer et al, 2005; Voisine et al, 1999)。研究表明,HSP70在有机体受到环境、生理或病理胁迫时会被诱导表达(曲凌云, 2004; 周朝伟等, 2018; Sun et al, 2019b)。目前,已有许多学者选择贝类完成对水体中有机物的富集及对贝类基因影响的研究,杨丹丹等(2019)利用高效液相色谱法检测厚壳贻贝(Mytilus coruscus)体内16种PAHs的含量。Murray等(1991)通过田间实验测定紫贻贝(Mytilus edulis)中PAHs的生物富集因子。王淑红等(2005)研究了翡翠贻贝外套膜、鳃、内脏团对16种PAHs的蓄积特征。刘娜(2012)研究了菲律宾蛤仔(Venerupis philippinarum)在苯并[a]芘胁迫下3种(芳烃受体蛋白、芳烃受体核转位因子和热休克蛋白90)基因表达分析。卢玮筱(2018)研究了在苯并[a]芘刺激下厚壳贻贝组织中RACK1基因的表达。
海洋双壳贝类分布广泛,营固着生活,是滤食性动物,对水体中有机污染物的积累性强,常作为监测海洋环境污染的指示生物。目前,关于贝类组织对PAHs蓄积规律的研究多集中于各组织对总PAHs的蓄积含量比较,如刘童(2015)比较了菲律宾蛤仔消化盲囊、鳃、闭壳肌、软体部对PAHs的蓄积含量规律。李天云等(2007)比较了河蚬(Corbicula fluminea)鳃、内脏团、肌肉对PAHs的蓄积含量关系。关于贝类体内HSP70 mRNA诱导表达的研究,其研究的诱导因子多为盐度、温度、重金属等,如Franzellitti等(2005)分别研究了热休克和汞对地中海贻贝体内HSP70 mRNA表达的影响,而对于单一多环芳烃PHE在贝类组织的蓄积规律研究以及PHE对贝类不同组织HSP70 mRNA表达影响的研究较少。
本研究选择厚壳贻贝为对象,通过对厚壳贻贝进行在不同浓度PHE溶液中的富集–释放实验,获得厚壳贻贝内脏团、外套膜及闭壳肌对PHE的富集和释放规律及HSP70 mRNA表达影响,为PHE在贝类体内的富集动力学及致毒机制提供参考依据。
1 材料与方法 1.1 实验材料实验海水为海水晶人工配制的海水,盐度为26,水温为(23±2)℃。厚壳贻贝为浙江省枸杞岛采集的人工养殖厚壳贻贝,平均壳长为(84.6±5.2) cm,壳宽为(40.9±2.5) cm,体重为(40.2±6.2) g。实验前将厚壳贻贝暂养7 d,期间连续充气,并投喂螺旋藻粉后选取健康个体进行实验,实验容器容积为20 L的玻璃缸体,装入海水14 L。
1.2 PHE的富集和释放 1.2.1 富集和释放实验实验分为富集和清水恢复2个阶段,分别进行10 d和5 d。以丙酮作为助溶剂,在预实验的基础上设置PHE分别为4、20、100 µg/L的实验组和人工海水对照组(加入0.01%丙酮),每组设3个平行。每组放入16只厚壳贻贝,每24 h换水1次,换水率100%,昼夜充气,每天定时投喂螺旋藻粉。分别于1、3、6、10、12和15 d随机取2只厚壳贻贝,分离其内脏团、外套膜、闭壳肌组织于–80℃保存,待检测分析。
1.2.2 组织中的PHE含量测定分别测定厚壳贻贝内脏团、外套膜和闭壳肌中的PHE含量,测定步骤如下:称取5.0 g湿样加入5 mL超纯水混合振摇,再加入15 mL乙腈剧烈振摇,以100 Hz 30℃超声5 min后加入1.5 g无水乙酸钠和6.0 g无水硫酸镁剧烈振摇,以4000 r/min离心5 min,取上清液;先用5 mL乙腈预淋洗Florisil/C18层析柱,再移取5 mL上清液通过层析柱过滤,再用15 mL乙腈继续洗脱,收集全部流出液于梨形瓶中,40℃旋转蒸发至约0.5 mL,用乙腈定容至1 mL,13, 000 r/min离心6 min,上清液过滤膜,移至进样瓶中,供高效液相色谱分析。
1.2.3 色谱条件Thermo SCIENTIFIC HYPERSIL Green PAH色谱柱(4.6 mm×150.0 mm, 5 µm);柱温位30℃;进样量为25 µL;流速为1.0 mL/min;紫外检测波长为245 nm;50%乙腈梯度洗脱。配制浓度分别为5、25、50、125和250 ng/mL的PHE标准液,绘制标准曲线。
1.3 HSP70 mRNA实验方法 1.3.1 样本准备及总RNA提取每个实验组取50 mg的厚壳贻贝内脏团、外套膜和闭壳肌加入1 mL Trizol,使用匀浆器进行匀浆处理;转移至RNase-free的离心管中,进行RNA的抽提。室温放置5 min,向离心管中加入预冷的氯仿(200 µL氯仿/1 mL Trizol),剧烈振荡15 s,室温放置10 min,离心(4℃,12, 000 r/min) 15 min;小心析出上层水相约500 µL,转移至无RNA酶的离心管中,加入等体积(500 µL)的异丙醇,颠倒混匀6~8次,–20℃冰箱放置30 min;再以10, 000 r/min低温离心15 min,可见RNA沉淀;弃上清液,加入650 µL 75%乙醇(75%乙醇的配制:1倍的DEPC处理水加3倍的无水乙醇)洗涤沉淀,8000 r/min低温离心5 min,弃上清液;重复上个步骤1遍,弃上清液,吸净残存乙醇,自然干燥5~10 min;加入适量的RNase-free H2O溶解RNA,–20℃冰箱,保存,待用。实验过程中,采用核酸蛋白测定仪检测RNA的纯度和浓度,以保证总RNA纯度较高、完整性较好,可直接用于后续的反转录以及荧光定量的研究。
1.3.2 反转录cDNA采用第一链cDNA合成试剂盒合成cDNA,配制逆转录反应体系,0.2 mL PCR管中加入以下试剂,混匀逆转录反应体系(总RNA、Random Primer p(dN)6、Rnase-free ddH2O、Reaction Buffer、dNTP Mix、Rnase inhibitor、AMV Reverse Transcriptase) (Thermo, #K1622)后37℃温浴5 min;再以42℃温浴60 min,最后70℃温浴10 min,终止反应。
1.3.3 Real-time PCR扩增根据Real-time PCR反应体系配制反应液。在PCR反应管中分别加入ddH2O、SybrGreen qPCR Master Mix(Thermo, F-415XL)、Forward primer、Reverse primer、cDNA模板,充分混匀;反应体系按照表 1配制。扩增条件:94℃ 10 min, (94℃ 20 s,55℃ 20 s,72℃ 20 s) 40个循环。
|
|
表 1 荧光定量PCR分析基因表达所用到的引物 Tab.1 Sequences of primers used in gene expression analyses by real-time fluorescence quantitative PCR |
用乙腈稀释PHE标准溶液,配制浓度分别为5、25、50、125和250 ng/mL的标准溶液,经1.2.3的色谱条件进行测定。PHE在0.2~20.0 ng/mL范围内,标准曲线线性回归方程为y=1.405 7x+0.443 8,相关系数r=0.999 6;以信噪比S/N=3,求得PHE检出限为0.1 µg/kg。
检测贻贝体内PHE含量为(4.040 3±0.596 0) µg/kg,用加标后测得的含量扣除本底值,计算得平均回收率为103.03%,RSD为5.6%,符合本实验方法要求。
1.4.2 2–∆∆Ct法Real-time PCR数据处理采用2–∆∆Ct法分析目的基因在对照组和各浓度组之间的表达差异,计算公式如下:∆Ct=Ct目的基因–Ct内参,再求得对照组∆Ct对照平均,用各组的∆Ct分别减去∆Ct对照,求得∆∆Ct值,即∆∆Ct=∆Ct样本–∆Ct对照平均,再计算各组2–∆∆Ct值,即为各组中基因的相对表达量。
1.5 数据统计分析所有数据结果采用SPSS 24.0软件进行统计学处理,使用单因素方差分析(one-way ANOVA)和Duncan´s多重比较判断组间差异的显著性,显著性水平为0.05。
2 结果与分析 2.1 丙酮作为助溶剂的可行性为了验证0.01%丙酮作为PHE的助溶剂的可行性,在实验过程中,对PHE的对照组和0.01%丙酮处理组中贻贝3种组织的PHE含量进行统计学检验。结果表明,对照组贻贝内脏团、外套膜和闭壳肌的PHE含量分别为(4.43±0.48)、(3.89±0.32)和(3.79±0.23) µg/kg,0.01%丙酮处理组贻贝内脏团、外套膜和闭壳肌的PHE含量分别为(4.43±0.54)、(3.97±0.27)和(3.92±0.22) µg/kg,二者相比无显著性差异(P > 0.05),说明0.01%丙酮作为PHE的助溶剂是可行的。
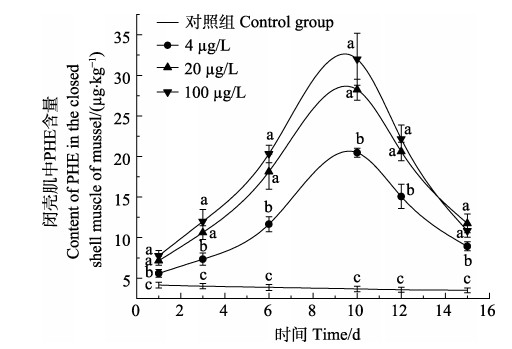
2.2 厚壳贻贝3种组织对PHE的富集和释放规律厚壳贻贝内脏团、外套膜和闭壳肌在4、20和100 µg/L PHE海水溶液中对PHE的富集和释放情况如图 1、图 2和图 3所示。厚壳贻贝3个组织对PHE的吸收速率和释放速率如表 2所示。在厚壳贻贝对PHE的富集阶段,内脏团、外套膜和闭壳肌中PHE富集量随时间的增加而增加。同时,也随PHE暴露浓度的增加而增加。内脏团在1、3、6和10 d时,3个浓度组之间PHE含量变化呈显著增加(P < 0.05)。

|
图 1 贻贝内脏团对PHE的富集和释放情况 Fig.1 Enrichment and release of phenanthrene (PHE) in the visceral mass of mussel a、b、c和d为各浓度组对照组之间相比差异显著(P < 0.05),下同 Single asterisk (a, b, c, and d) indicates significant difference among treatment groups and control group (P < 0.05), the same as below |

|
图 2 贻贝外套膜对PHE的富集和释放情况 Fig.2 Enrichment and release of phenanthrene (PHE) in the outer membrane of mussel |
|
图 3 贻贝闭壳肌对PHE的富集和释放情况 Fig.3 Enrichment and release of phenanthrene (PHE) in the closed shell muscle of mussel |
|
|
表 2 厚壳贻贝3个组织对PHE的吸收速率和释放速率 Tab.2 Enrichment and release rates of PHE in three tissues of mussels |
外套膜在1 d时,4和20 µg/L浓度组PHE含量无显著差异(P > 0.05);在3 d时,3个浓度组PHE含量无显著差异(P > 0.05);在6和10 d时,3个浓度组PHE含量呈显著增加的趋势(P < 0.05)。闭壳肌在1、3、6和10 d时,20和100 µg/L浓度组PHE含量无显著差异(P > 0.05),同时,4 µg/L浓度组PHE含量呈显著增加的趋势(P < 0.05)。厚壳贻贝3个组织对PHE的富集含量和富集速度表现为内脏团 > 外套膜 > 闭壳肌。
在5 d的释放阶段,厚壳贻贝3个组织对PHE的释放速率规律不同。其中,内脏团对PHE的释放速率随暴露浓度变化不大,外套膜对PHE的释放速率随暴露浓度的增加而降低,闭壳肌对PHE的释放速率随暴露浓度的增加而升高。内脏团PHE释放速率分别为58.72% (4 µg/L)、50.71%(20 µg/L)和54.60% (100 µg/L);外套膜PHE释放速率分别为72.82% (4 µg/L)、68.35% (20 µg/L)和38.65% (100 µg/L);闭壳肌PHE释放速率分别为56.41% (4 µg/L)、58.35% (20 µg/L)和66.11% (100 µg/L)。在释放前期,厚壳贻贝3个组织内的PHE含量急剧下降,在清水恢复的第4、5天,3个组织内PHE浓度释放速度减慢。
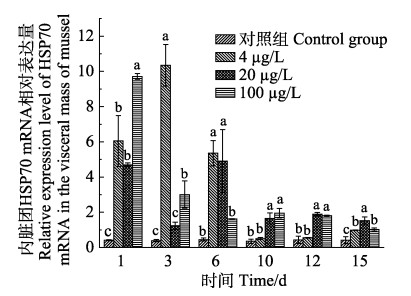
2.3 PHE诱导厚壳贻贝3种组织中HSP70 mRNA的表达分析暴露在PHE浓度溶液中厚壳贻贝3种组织HSP70 mRNA水平变化如图 4、图 5和图 6所示。厚壳贻贝内脏团、外套膜和闭壳肌中HSP70 mRNA的表达均有变化。在富集阶段,厚壳贻贝外套膜HSP70 mRNA表达量明显高于内脏团和闭壳肌,其中,在PHE低、中和高浓度溶液暴露下,外套膜中HSP70 mRNA表达量均在第1天时达到最高值,分别是对照组的35.7倍(4 µg/L)、47.8倍(20 µg/L)和70.1倍(100 µg/L);内脏团中HSP70 mRNA表达量分别在第3、6和1天时达到最高值,分别是对照组的26.3倍(4 µg/L)、10.9倍(20 µg/L)和23倍(100 µg/L);闭壳肌中HSP70 mRNA表达量分别在第3、1和6天时达到最高值,分别是对照组的2.8倍(4 µg/L)、3.2倍(20 µg/L)和3.5倍(100 µg/L)。
|
图 4 菲暴露及释放下厚壳贻贝内脏团中HSP70的相对表达量 Fig.4 Relative expression of HSP70 in the visceral mass of mussel exposed and released by PHE |

|
图 5 菲暴露及释放下厚壳贻贝外套膜中HSP70的相对表达量 Fig.5 Relative expression of HSP70 in the outer membrane of mussel after exposure and release of PHE |

|
图 6 菲暴露及释放下厚壳贻贝闭壳肌中HSP70的相对表达量 Fig.6 Relative expression of HSP70 in the closed shell muscle of musselexposed and released by PHE |
厚壳贻贝在PHE的整个富集释放过程中,3个组织中HSP70 mRNA表达量的变化规律各不相同。从图 4可以看出,3个浓度PHE对厚壳贻贝内脏团中HSP70 mRNA诱导表达,4 µg/L浓度组在1 d时,HSP70 mRNA表达量较对照组显著增加(P < 0.05);在3 d时,HSP70 mRNA表达量达到最高值;随后随着时间增加,HSP70 mRNA表达量逐渐降低。20 µg/L浓度组在1 d时,HSP70 mRNA表达量较对照组显著增加(P < 0.05);在3 d时,HSP70 mRNA表达量降低且较对照组无显著差异(P > 0.05);在6 d时,HSP70 mRNA表达量达到最高值;后随时间的增加,HSP70 mRNA表达量逐渐降低。100 µg/L浓度组在1 d时,HSP70 mRNA表达量为最高值;随后随时间的增加,HSP70 mRNA表达量逐渐降低,但都较对照组显著增加(P < 0.05)。
从图 5可以看出,3个浓度PHE对厚壳贻贝外套膜HSP70 mRNA诱导表达,4、20和100 µg/L浓度组在1 d时,HSP70 mRNA表达量较对照组呈极显著增加(P < 0.01);在3 d时,各浓度组HSP70 mRNA表达量达到最高值;随后随时间的增加,各浓度组HSP70 mRNA表达量逐渐降低,但都较对照组显著增加(P < 0.05)。
3个浓度PHE对厚壳贻贝闭壳肌HSP70 mRNA诱导表达情况见图 6。4 µg/L浓度组在1 d时,HSP70 mRNA表达量较对照组显著增加(P < 0.05);在3 d时HSP70 mRNA表达量达到最高值;后随时间的增加,HSP70 mRNA表达量逐渐降低,在10和12 d时,HSP70 mRNA表达量较对照组显著降低(P < 0.05),呈抑制表达状态;在15 d时,HSP70 mRNA表达量较对照组无显著差异(P > 0.05)。20 µg/L浓度组在1 d时,HSP70 mRNA表达量达最高值;后随时间增加,HSP70 mRNA表达量逐渐降低,直至第6天时,HSP70 mRNA表达量达最低值;之后HSP70 mRNA表达量又随时间的增加而增加。100 µg/L浓度组在1 d时,HSP70 mRNA表达量较对照组显著增加(P < 0.05);在3 d时,HSP70 mRNA表达量较对照组无显著差异(P > 0.05);在6 d时,HSP70 mRNA表达量增加至最高值;在10和12 d时,HSP70表达量较对照组无显著差异(P > 0.05);在15 d时,HSP70 mRNA表达量较对照组显著增加(P < 0.05)。
3 讨论 3.1 厚壳贻贝3种组织对PHE的富集和释放规律PHE作为低分子量PAHs的典型代表,在水中溶解度较大,且具有高亲脂性、易渗透生物膜、在水生生物体内快速富集的特点(Ademollo et al, 2017)。本研究表明,在同一时间、同一暴露浓度下,厚壳贻贝3个组织对PHE的富集含量规律为内脏团 > 外套膜 > 闭壳肌。3个组织对PHE的富集含量随时间的增加而增加,同时,也随PHE暴露浓度的增加而增加。其原因主要有以下几个,首先,PHE自身具有较高的正辛醇/水分配系数,脂溶性较强,实验中使用丙酮作为助溶剂,提高了PHE的生物利用性,使PHE通过细胞的被动扩散作用与脂肪组织相结合,提高了厚壳贻贝的富集作用;其次,厚壳贻贝主要是通过过滤海水摄食,海水在经过鳃的过滤后,较大颗粒物质沉淀在外套膜上,较小颗粒物质进入内脏团的消化器(王淑红等, 2005)。本研究中,PHE随水流进入厚壳贻贝各组织并迅速溶于脂肪,由于PHE具有脂溶性,易在各组织中累积;最后,PAHs在生物组织内的累积程度与脂肪含量有关,脂肪含量高的组织更容易富集PAHs (Wang et al, 2011)。贝类各湿样组织脂肪含量比较,内脏团的脂肪含量最大(杨慧赞, 2008)。外套膜作为与水体直接接触的组织,能吸附或吸收水体中的PHE。因此,比闭壳肌富集PHE的含量要高,这与宫向红等(2017)报道PAHs在海湾扇贝不同组织中富集规律一致。
当厚壳贻贝开始处于清水释放状态时,各组织对PHE的释放主要受控于热力学驱动的扩散、酶系统调控的新陈代谢活动和排泄作用(Baussant et al, 2001),这2种作用使厚壳贻贝各组织内的PHE含量在释放阶段前期开始迅速降低,随着释放时间的延长,厚壳贻贝各组织内PHE含量逐渐降低,经过5 d的释放,厚壳贻贝内脏团PHE释放速率在50%~60%之间,外套膜PHE释放速率随暴露浓度的升高逐渐降低,闭壳肌PHE释放速率随暴露浓度的升高逐渐升高,这与组织特异性有关。与外套膜、闭壳肌相比,内脏团中存在大量酶系参与PHE的代谢过程,使3个浓度组内脏团的释放速率相差不大;而外套膜中PHE的排出则主要是通过血细胞渗出,这种作用相对酶的作用来说较弱,导致外套膜中PHE的释放速率随暴露浓度升高逐渐降低。
3.2 PHE诱导厚壳贻贝3种组织中HSP70 mRNA的表达分析热休克蛋白70 (HSP70)是一类应激蛋白,常在细胞受到外界环境胁迫时应激表达,与许多信号转导途径的关键调节因子相互作用,控制细胞的稳态、增殖、分化和细胞死亡(Mayer et al, 2005)。从本研究可以看出,3个组织HSP70 mRNA表达的剂-效关系随时间变化规律不同。本研究中,在PHE暴露初期,厚壳贻贝内脏团、外套膜和闭壳肌HSP70 mRNA表达量都较对照组显著增加,这是由于机体受到PHE胁迫时,为防止细胞内蛋白凝聚或变性,维持细胞内环境稳定,HSP70 mRNA被诱导表达来增强机体抗刺激及生存能力。随着暴露在PHE水溶液中时间的增加,厚壳贻贝体内对PHE的富集量逐渐增加,内脏团、外套膜及闭壳肌中HSP70 mRNA表达量在1、3或6 d时达到最高值,这可能是因为不同组织其HSP70 mRNA表达具有差异性。内脏团和外套膜中HSP70 mRNA表达量达最高值后,HSP70 mRNA表达量开始逐渐降低,可能是由于细胞中PHE浓度超过阈值时,机体细胞的生物合成能力遭到破坏,HSP70 mRNA的表达量将会降低或者被抑制,说明热休克蛋白70的表达对细胞的保护是有一定范围的(Eckwert et al, 1997)。这与荆圆圆等(2019)研究不同盐度下,镉对太平洋牡蛎(Crassostrea gigas)不同组织HSP70 mRNA表达影响结果一致。而闭壳肌中,HSP70 mRNA在6、10和12 d受到抑制表达后,在第15天时仍能恢复正常表达量,这可能是因为闭壳肌中,HSP70 mRNA表达量随PHE含量降低至一定值后,将不受抑制表达。由于HSP70 mRNA在厚壳贻贝内脏团、外套膜和闭壳肌中是组成性表达(程培周等, 2007),PHE对厚壳贻贝3个组织中HSP70诱导表达量高低排序为外套膜 > 内脏团 > 闭壳肌。
4 结论在富集阶段,厚壳贻贝3个组织对PHE的富集能力大小表现为内脏团 > 外套膜 > 闭壳肌。同时,3个组织对PHE的富集含量随时间的增加而增加,也随PHE暴露浓度的增加而增加。在清水恢复前期,厚壳贻贝3个组织中PHE含量迅速下降;在第15天时,厚壳贻贝内脏团3个浓度组PHE释放速率在50%~ 60%之间,外套膜PHE释放速率随暴露浓度的升高逐渐降低,闭壳肌PHE释放速率随暴露浓度的升高逐渐升高。PHE对厚壳贻贝内脏团、外套膜和闭壳肌的HSP70 mRNA诱导表达具有组织特异性,其中,外套膜中HSP70 mRNA表达量最高。
ADEMOLLO N, PATROLECCO L, MATOZZO V, et al. Clam bioaccumulation of alkylphenols and polyciclic aromatic hydrocarbons in the Venice lagoon under different pressures. Marine Pollution Bulletin, 2017, 124(1): 121-129 DOI:10.1016/j.marpolbul.2017.07.020 |
BAUSSANT T, SANNI S, JONSSON G, et al. Bioaccumulation of polycyclic aromatic compounds: 1. Bioconcentration in two marine species and in semipermeable membrane devices during chronic exposure to dispersed crude oil. Environmental Toxicology and Chemistry, 2001, 20(6): 1175-1184 |
CHENG P Z, LIU X, ZHANG G F, et al. Fluorescence quantitative PCR analysis of HSP70 expression in Haliotis discus hannai Ino under temperature stress. Marine Sciences, 2007, 31(10): 77-81 [程培周, 刘晓, 张国范, 等. 荧光定量PCR方法分析皱纹盘鲍HSP70在温度胁迫下的表达. 海洋科学, 2007, 31(10): 77-81 DOI:10.3969/j.issn.1000-3096.2007.10.020] |
ECKWERT H, ALBERTI G, KOHLER H R. The induction of stress proteins (hsp) in Oniscus asellus (Isopoda) as a molecular marker of multiple heavy metal exposure: I. Principles and toxicological assessment. Ecotoxicology, 1997, 6(5): 249-262 |
FRANZELLITTI S, FABBRI E. Differential HSP70 gene expression in the Mediterranean mussel exposed to various stressors. Biochemical and Biophysical Research Communications, 2005, 336(4): 1157-1163 DOI:10.1016/j.bbrc.2005.08.244 |
GONG X H, SUN S, LIU X J, et al. Accumulation and elimination of diesel in scallop Argopecten irradians. Journal of Fishery Sciences of China, 2017, 24(4): 811-823 [宫向红, 孙珊, 刘小静, 等. 海湾扇贝对柴油的富集与消除规律. 中国水产科学, 2017, 24(4): 811-823] |
GU Y G, KE C L, LIU Q, et al. Polycyclic aromatic hydrocarbons (PAHs) in sediments of Zhelin Bay, the largest mariculture base on the eastern Guangdong coast, South China: Characterization and risk implications. Marine Pollution Bulletin, 2016, 110(1): 603-608 DOI:10.1016/j.marpolbul.2016.06.025 |
JIA S L, ZHENG S, LONG J Q, et al. Research progress on polycyclic aromatic hydrocarbons in water. Guizhou Science, 2020, 38(2): 21-30 [贾双琳, 郑松, 龙纪群, 等. 水中多环芳烃分析技术研究进展. 贵州科学, 2020, 38(2): 21-30] |
JING Y Y, ZHANG T W, LIU E F, et al. Effects of cadmium on heat shock protein 70 gene expression in different tissues of Crassostrea gigas under different salinity. Journal of Guangxi Academy of Sciences, 2019, 35(4): 332-336 [荆圆圆, 张天文, 刘恩孚, 等. 不同盐度下镉对太平洋牡蛎不同组织热休克蛋白70基因表达的影响. 广西科学院学报, 2019, 35(4): 332-336] |
KARAMI A, ROMANO N, HAMZAH H, et al. Acute phenanthrene toxicity to juvenile diploid and triploid African catfish (Clarias gariepinus): Molecular, biochemical, and histopathological alterations. Environmental Pollution, 2016, 212(55): 155-165 |
KESHAVARZIFARD M, ZAKARIA M P, SHARIFI R. Ecotoxicological and health risk assessment of polycyclic aromatic hydrocarbons (PAHs) in short-neck clam (Paphia undulata) and contaminated sediments in Malacca Strait, Malaysia. Archives of Environmental Contamination and Toxicology, 2017, 73(3): 474-487 DOI:10.1007/s00244-017-0410-0 |
LI L, SHENG X Q, LI C, et al. Bioaccumulation-depuration kinetics of benzo [a] pyrene and phenanthrene in Sinonovacula constricta. Journal of Fisheries of China, 2015, 39(7): 998-1004 [李磊, 沈新强, 李超, 等. 苯并[a]芘、菲在缢蛏体内的生物富集与释放. 水产学报, 2015, 39(7): 998-1004] |
LI T Y, SUN F, HUANG S B, et al. The concentration and tissues accumulation of polycyclic aromatic hydrocarbons (PAHs) and organochlorine pesticides (OCPs) in Corbicula fluminea of Minjiang River. Journal of Southwest China Normal University (Natural Science), 2007, 32(6): 72-77 [李天云, 孙凡, 黄圣彪, 等. 闽江某河段河蚬组织中多环芳烃和有机氯农药的蓄积特征. 西南师范大学学报(自然科学版), 2007, 32(6): 72-77 DOI:10.3969/j.issn.1000-5471.2007.06.015] |
LIU N. Selection of differential expression genes and study of molecular biomarkers of clam Venerupis philippinarum exposed to Benzo (a) pyrene. Master′s Thesis of Ocean University of China, 2012 [刘娜. 菲律宾蛤仔(Venerupis philippinarum)在苯并(a)芘胁迫下差异基因的筛选与分子生物标志物的研究. 中国海洋大学硕士研究生学位论文, 2012]
|
LIU T. Biological monitoring technology research of offshore PAHs in the clam Ruditapes philippinarum. Doctoral Dissertation of Ocean University of China, 2015 [刘童. 基于菲律宾蛤仔的近海多环芳烃生物监测技术的研究. 中国海洋大学博士研究生学位论文, 2015]
|
LU W X. Effects of unialgal diets on the biological characteristics of Eurytemora pacifica and transcriptome analysis. Master′s Thesis of Zhejiang Ocean University, 2018 [卢玮筱. 厚壳贻贝RACK1基因在脂多糖、铜离子、苯并芘刺激下的表达. 浙江海洋大学硕士研究生学位论文, 2018]
|
MAYER M P, BUKAU B. Hsp70 chaperones: Cellular functions and molecular mechanism. Cellular and Molecular Life Sciences, 2005, 62(6): 670-684 DOI:10.1007/s00018-004-4464-6 |
MOKKONGPAI P, KANCHANOPAS-BARNETT P, SAWANGWONG P. Accumulation of polycyclic aromatic hydrocarbons (PAHs) in green mussels (Perna viridis) collected from the east coast of Chon Buri Province, Thailand. Journal of Science Technology and Humanities, 2010, 8(1): 13-23 |
MURRAY A P, RICHARDSON B J, GIBBS C F. Bioconcentration factors for petroleum hydrocarbons, PAHs, LABs and biogenic hydrocarbons in the blue mussel. Marine Pollution Bulletin, 1991, 22(12): 595-603 DOI:10.1016/0025-326X(91)90247-P |
PENG X D, SUN X X, YU M, et al. Chronic exposure to environmental concentrations of phenanthrene impairs zebrafish reproduction. Ecotoxicology and Environmental Safety, 2019, 182: 109376 DOI:10.1016/j.ecoenv.2019.109376 |
PIAZZA R S, TREVISAN R, FLORES-NUNES F, et al. Exposure to phenanthrene and depuration: Changes on gene transcription, enzymatic activity and lipid peroxidation in gill of scallops Nodipecten nodosus. Aquatic Toxicology, 2016, 177(25): 146-155 |
QU L Y. Expression under adversity and cloning analysis of a heat shock protein70 (HSP70) in three species of cultured scallop. Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2004 [曲凌云. 三种养殖扇贝热休克蛋白HSP70在逆境因子下的表达和相关基因的克隆. 中国科学院海洋研究所博士研究生学位论文, 2004]
|
RABODONIRINA S, RASOLOMAMPIANINA R, KRIER F, et al. Degradation of fluorene and phenanthrene in PAHs-contaminated soil using Pseudomonas and Bacillus strains isolated from oil spill sites. Journal of Environmental Management, 2019, 232(5): 1-7 |
SHIRMOHAMMADI M, CHUPANI L, SALAMAT N. Responses of immune organs after single-dose exposure to phenanthrene in yellowfin seabream (Acanthopagrus latus): CYP1A induction and oxidative stress. Chemosphere, 2017, 186(51): 686-694 |
SUN M, LIU G, LIN H, et al. Effect of feeding strategies on molecular responses of biotransformation genes in Crassostrea gigas exposed to cadmium. Journal of Ocean University of China, 2019a, 18(4): 883-888 DOI:10.1007/s11802-019-3898-2 |
SUN T, WANG D, TANG Y, et al. Fabric-phase sorptive extraction coupled with ion mobility spectrometry for on-site rapid detection of PAHs in aquatic environment. Talanta, 2019b, 195(18): 109-116 |
VOISINE C, CRAIG E A, ZUFALL N, et al. The protein import motor of mitochondria: Unfolding and trapping of preproteins are distinct and separable functions of matrix Hsp70. Cell, 1999, 97(5): 565-574 DOI:10.1016/S0092-8674(00)80768-0 |
WANG L, PAN L Q, LIU N, et al. Biomarkers and bioaccumulation of clam Ruditapes philippinarum in response to combined cadmium and benzo[a]pyrene exposure. Food and Chemical Toxicology, 2011, 49(12): 3407-3417 DOI:10.1016/j.fct.2011.06.015 |
WANG S H, WANG X H, HONG H S. Specific characteristic of tissue bioaccumulation of PAHs in green lipped mussels (Perna viridis) at different growth stages. Marine Environmental Science, 2005, 24(3): 29-32 [王淑红, 王新红, 洪华生. 不同生长期翡翠贻贝(Perna viridis)体内多环芳烃富集的组织特异性研究. 海洋环境科学, 2005, 24(3): 29-32 DOI:10.3969/j.issn.1007-6336.2005.03.008] |
WU J Y, XU G D, LIN Y F, et al. Development of freshwater aquatic life water quality criteria for phenanthrene in China. Acta Scientiae Circumstantiae, 2018, 38(1): 399-406 [武江越, 许国栋, 林雨霏, 等. 我国淡水生物菲水质基准研究. 环境科学学报, 2018, 38(1): 399-406] |
XU G P, JIANG M, LI L, et al. Effect of benzo[a] pyrene on the P4501A1, P-glycoprotein and HSP70 expression in Portunus trituberculatus. Marine Environmental Science, 2015, 34(5): 647-653 [许高鹏, 蒋玫, 李磊, 等. 苯并[a]芘(BaP)暴露对三疣梭子蟹(Portunus trituberculatus) P4501A1, P-gp, HSP70基因表达的影响. 海洋环境科学, 2015, 34(5): 647-653] |
YAKAN S D, HENKELMANN B, SCHRAMM K W, et al. Bioaccumulation-depuration kinetics and effects of phenanthrene on Mediterranean mussel (Mytilus galloprovincialis). Journal of Environmental Science and Health, 2013, 48(9): 1037-1046 DOI:10.1080/10934529.2013.773799 |
YANG D D, HAN F, SHI Y F, et al. Determination of 16 polycyclic aromatic hydrocarbons in shellfish by high performance liquid chromatography with UV/fluorescence detection. Chinese Journal of Analysis Laboratory, 2019, 38(7): 828-833 [杨丹丹, 韩峰, 史永富, 等. 高效液相色谱-紫外/荧光测定贝类体内16种多环芳烃. 分析试验室, 2019, 38(7): 828-833] |
YANG F, ZHAI Y X, REN D D, et al. Determination of sixteen polycyclic aromatic hydrocarbons in marine sediments by high performance liquid chromatography with fluorescence and ultraviolet detection. Progress in Fishery Sciences, 2013, 34(5): 104-111 [杨帆, 翟毓秀, 任丹丹, 等. 高效液相色谱-荧光/紫外串联测定海洋沉积物16种多环芳烃. 渔业科学进展, 2013, 34(5): 104-111 DOI:10.3969/j.issn.1000-7075.2013.05.016] |
YANG H Z. Toxicokinetics and toxicodynamics for benzo[a]pyrene in Chlamys farreri. Master′s Thesis of Ocean University of China, 2008 [杨慧赞. 苯并[a]芘在栉孔扇贝(Chlamys farreri)体内的毒代与毒效动力学研究. 中国海洋大学硕士研究生学位论文, 2008]
|
YIN S S, TANG M L, CHEN F F, et al. Environmental exposure to polycyclic aromatic hydrocarbons (PAHs): The correlation with and impact on reproductive hormones in umbilical cord serum. Environmental Pollution, 2017, 220(90): 1429-1437 |
ZHENG B H, WANG L P, LEI K, et al. Distribution and ecological risk assessment of polycyclic aromatic hydrocarbons in water, suspended particulate matter and sediment from Daliao River estuary and the adjacent area, China. Chemosphere, 2016, 149(39): 91-100 |
ZHOU C W, HU X W, LEI L, et al. Effects of heat stress on biochemical indices and HSP70 mRNA expression in gibel carp (Carassius auratus gibelio). Progress in Fishery Sciences, 2018, 39(6): 65-71 [周朝伟, 胡续雯, 雷骆, 等. 热应激对银鲫生化指标和HSP70 mRNA表达的影响. 渔业科学进展, 2018, 39(6): 65-71] |



