2. 浙江万里学院 浙江水产种质资源高效利用技术研究重点实验室 浙江 宁波 315100;
3. 浙江万里学院 宁海海洋生物种业研究院 浙江 宁海 315604
2. Zhejiang Key Laboratory of Aquatic Germplasm Resources, College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo, Zhejiang 315100, China;
3. Ninghai Institute of Maricultural Breeding and Seed Industry, Zhejiang Wanli University, Ninghai, Zhejiang 315604, China
水温是影响贝类存活、生长发育、免疫功能和分布的主要环境因子之一。水温超过一定范围,机体会产生热应激反应,导致其生理功能减弱、免疫功能降低,甚至死亡。研究发现,华贵栉孔扇贝(Chlamys nobilis)死亡率与水温呈正相关,且具有时间依赖性(Cheng et al, 2020);长牡蛎(Crassostrea gigas)在夏季更易受致病菌感染(Ugalde et al, 2018);虾夷扇贝(Patinopecten yessoensis)高温胁迫后,肝胰腺中过氧化氢酶(CAT)含量显著降低(Jiang et al, 2019);虾夷扇贝、凸壳肌蛤(Arcuatula senhousei)和魁蚶(Scapharca broughtonii)耗氧率和排氨率随水温升高呈先上升后下降的趋势(Hao et al, 2014; 吕旭宁等, 2018; 薛素燕等, 2019);四角蛤蜊(Mactra veneriformis)高温胁迫后血细胞吞噬活性和溶菌酶活性降低,造成其免疫功能抑制(Yu et al, 2009)。
近年来,随着分子生物学技术的发展,贝类耐高温分子机制研究取得一系列进展。研究表明,分子伴侣和未折叠蛋白反应是生物体在应激条件下抵抗外界压力和维持蛋白稳态的关键(Zhu et al, 2016; Zhou et al, 2019)。对3种扇贝和菲律宾蛤仔(Ruditapes philippinarum)研究发现,热胁迫下机体通过合成HSPs维持蛋白稳态(Brun et al, 2008; Nie et al, 2017; Cheng et al, 2020)。热胁迫后,长牡蛎和虾夷扇贝通过上调未折叠蛋白反应基因GRP94、GRP78和PDIA6增强蛋白折叠功能(Yang et al, 2017; Jiang et al, 2019)。随胁迫时间延长,机体内大分子受损,细胞凋亡途径被激活,引起凋亡基因表达,如贻贝(Mytilus galloprovincialis、M. coruscus和M. californianus) Caspase-3/8基因表达上调(Yao et al, 2012; Zhang et al, 2014)。
随着全球气候变暖和极端高温天气频率增加,海域温度逐年升高,生活在潮间带的贝类极易遭受高温胁迫而引发死亡,造成巨大的经济损失。缢蛏(Sinonovacula constricta)属广温性贝类,我国南北沿海均有分布,在8℃~30℃海水中能正常生活(王如才等, 2008),因其活动范围有限,自身已进化出特殊的防御机制以抵御高温胁迫,但高温仍是影响其生长和诱发疾病的重要环境因素之一。因此,开展缢蛏高温适应性研究对其养殖的可持续发展具有重要意义。目前,缢蛏基因组已公布(Dong et al, 2020),关于其耐高温性状关联分析及转录组研究也有报道,如薛宝宝等(2019)开发了4个与其耐高温性状相关的SNP候选标记;Zhang等(2019)通过转录组分析发现,缢蛏通过上调BAG3和NF-κB α抑制剂(NFIA)等的表达应对高温胁迫。尽管如此,目前对缢蛏高温耐受分子机制的认识仍不全面。本研究基于缢蛏高温胁迫转录组分析,结合文献资料筛选高温应答相关基因,并检测其在不同温度骤变后在鳃和肝胰腺中的表达变化规律,旨在为缢蛏高温响应分子机制的研究提供理论基础,为后续开展分子标记辅助育种提供理论依据。
1 材料与方法 1.1 实验材料实验用缢蛏于2019年9月采自浙江宏野海产品有限公司,挑选活力好的个体约400粒[壳长(62.00± 2.13) mm、壳高(20.52±0.66) mm、湿重(12.80±1.91) g]在实验室暂养3 d,期间每天08:00和18:00投喂角毛藻(Chaetoceros)和小球藻(Chlorella sp.)混合液500 mL (约5×104 cells/mL),24 h持续充气,每天换水1次。
1.2 高温胁迫与样品采集将缢蛏随机分为4组,即对照组(22℃)和实验组(30℃、32℃和34℃),进行急性胁迫,恒温加热棒控温。期间不投喂,保持充气,盐度控制在20左右。每组分别在0、4、8、12、24和48 h,随机挑选6粒缢蛏,取鳃和肝胰腺于液氮速冻,储存于–80℃冰箱。
1.3 RNA提取与引物设计利用Total RNA extractor试剂盒(上海生工)提取总RNA,1%琼脂糖电泳检测其完整性,微量分光光度计(Nano300)检测其浓度。用PrimeScript® RT reagent kit with gDNA eraser (TaKaRa, 日本)合成cDNA,基于基因组序列开放阅读框设计引物(表 1)。
|
|
表 1 基因qRT-PCR引物信息 Tab.1 Primer information of genes in qRT-PCR |
以鳃和肝胰腺cDNA稀释100倍为qRT-PCR模板,18S rRNA (F: TCGGTTCTATTGCGTTGGTTTT,R: CAGTTGGCATCGTTTATGGTCA)为内参基因,在LightCycler® 480 Instrument ⅡPCR仪(Roche, 美国)上进行qRT-PCR反应,总体系20 μL:SYBR qPCR master mix (Vazyme) 10 μL,上下游引物各1 μL,cDNA和ddH2O共8 μL。反应程序:95℃预变性10 min,95℃变性10 s,60℃退火30 s,循环40次,熔解曲线:95℃ 15 s,60℃ 60 s,95℃ 15 s。每组3个生物学平行,3个技术重复。
1.5 数据分析以2–ΔΔCt法(Livak et al, 2002)计算基因相对表达量,用平均值±标准误(Mean±SE)表示。用SPSS 22.0进行独立样本T检验。用GraphPad Prism 8.0绘图。
2 结果 2.1 高温胁迫后转录组中候选基因差异表达分析基于缢蛏高温胁迫鳃和肝胰腺转录组分析(SUB9002458和PRJNA695103),筛选出热应激相关基因(表 2),结果与qRT-PCR表达模式一致。32℃急性胁迫24 h后,不同基因的表达存在组织特异性,分子伴侣类基因在鳃中响应更明显,且PDIA6、GRP94和CALR在鳃中的表达量高;免疫类基因CTSL和CTL仅在肝胰腺中上调。细胞凋亡基因Caspase 3在鳃和肝胰腺中均下调。
|
|
表 2 相关基因在转录组中的表达水平 Tab.2 Expression levels of genes in the transcriptome |
高温胁迫下,分子伴侣基因在鳃中表达与温度呈正相关,在肝胰腺中表达随温度升高总体呈先上升后下降趋势,且鳃较肝胰腺更早做出响应(图 1和图 2)。
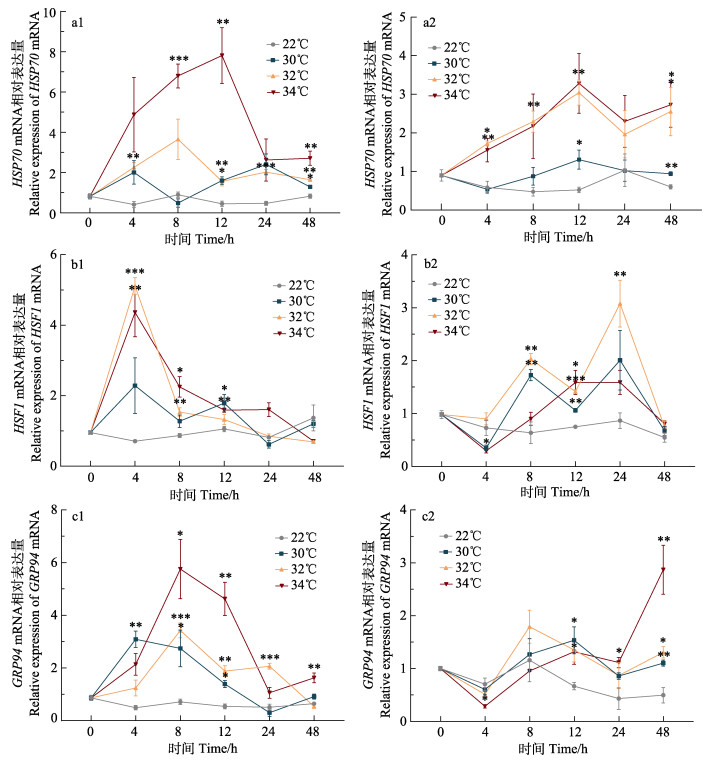
|
图 1 高温胁迫对缢蛏热休克分子伴侣基因表达的影响 Fig.1 Effects of high-temperature stress on the expression of shock molecular chaperone genes in S. constricta 1:鳃;2:肝胰腺。*表示与对照组差异显著(*P < 0.05, **P < 0.01, ***P < 0.001),误差线表示平均值±标准误(n=3)。下同 1: Gill; 2: Hepatopancreas. * represents significant differences between the different temperature stress with control at same time (*P < 0.05, **P < 0.01, ***P < 0.001). The vertical bars represent the Mean±SE (n=3). The same as below |

|
图 2 高温胁迫对缢蛏其他分子伴侣基因表达的影响 Fig.2 Effects of high-temperature stress on the expression of other molecular chaperone genes in S. constricta 1:鳃;2:肝胰腺 1: Gill; 2: Hepatopancreas |
30℃时,HSP70 mRNA在鳃和肝胰腺中变化基本不显著;32℃时,其在鳃和肝胰腺中表达量分别在8 h (4.06倍)和12 h (5.84倍)达到峰值;34℃时,其在鳃和肝胰腺中表达量均在4 h开始升高,12 h达到峰值,为对照组的17.11倍和6.30倍(图 1a1、a2)。
不同温度胁迫下,HSF1基因在鳃和肝胰腺中表达趋势不同。30℃时,鳃和肝胰腺中HSF1 mRNA变化基本不显著;32℃时,其在鳃中4 h开始显著升高(P < 0.001),为对照组的7.19倍,随之逐渐降低,48 h时低于对照组;在肝胰腺中8 h开始显著升高(P < 0.01),12 h略有回落,24 h时达到峰值(3.55倍),随之恢复到对照水平;34℃时,其在鳃和肝胰腺中变化总体呈先升高后下降的趋势,分别在4 h和12 h达到峰值,为对照组的6.14倍和2.17倍(图 1b1、b2)。
GRP94基因在鳃中变化更显著。30℃时,鳃和肝胰腺中GRP94基因表达量在4 h和12 h达到峰值,显著高于对照组(P < 0.05);32℃时,在鳃中表达量4 h开始升高,8 h达到峰值,显著高于对照组(P < 0.001);在肝胰腺中变化不显著;34℃时,其表达量在鳃中呈先升高后下降的趋势,在肝胰腺中持续上升,分别在8 h和48 h达到峰值,为对照组的8.08倍和5.76倍(图 1c1、c2)。
30℃时,BAG3基因在鳃和肝胰腺中变化基本不显著;32℃时,其在鳃和肝胰腺中变化均呈先升高后下降的趋势,均在4 h时达到峰值;34℃时,其在鳃和肝胰腺中变化均呈先升高后降低再升高的趋势,均在4 h达到峰值,分别为对照组的6.64倍和11.43倍(图 2a1、a2)。
PDIA6在鳃中变化较显著。30℃和32℃时,其在鳃和肝胰腺中表达均呈先上升后下降的趋势,均在4 h和8 h达到峰值,显著高于对照组(P < 0.05);34℃时,在鳃中8 h表达量达到峰值,为对照组的8.03倍;在肝胰腺中48 h时表达量达到峰值(7.39倍)(图 2b1、b2)。
CALR mRNA在鳃中变化更加显著。30℃时,在鳃和肝胰腺中变化均呈先上升后下降的趋势,分别在4 h和8 h达到峰值,为对照组的4.40倍和5.80倍。32℃时,其在鳃和肝胰腺中分别在4 h和8 h表达量开始显著升高(P < 0.05),4 h和12 h达到峰值,为对照组的9.07倍和7.76倍。34℃时,其在鳃中12 h时表达量达到峰值,显著高于对照组(P < 0.05);在肝胰腺中变化与时间呈正相关,8 h开始显著升高(P < 0.05),48 h时达到峰值(图 2c1、c2)。
2.3 高温胁迫对代谢与免疫类基因mRNA表达的影响高温胁迫下,鳃和肝胰腺中的代谢与免疫类基因随温度的升高总体呈先升高后下降的趋势,肝胰腺响应更加显著,其中,CTL仅在肝胰腺中表达,且与温度呈正相关(图 3)。
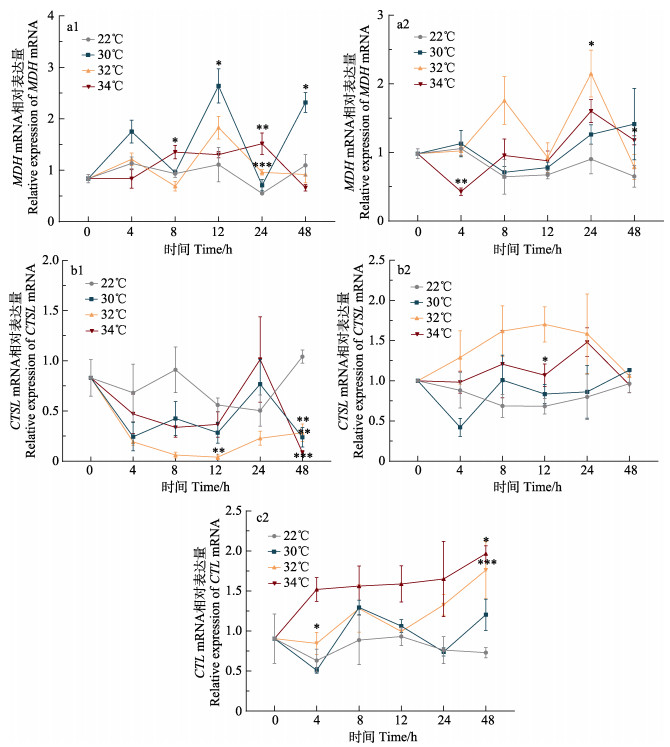
|
图 3 高温胁迫对缢蛏代谢和免疫类基因表达的影响 Fig.3 Effects of high-temperature stress on the expression of metabolic and immune related genes in S. constricta 1:鳃;2:肝胰腺 1: Gill; 2: Hepatopancreas |
30℃时,MDH mRNA在鳃中12 h时显著升高且达到峰值(P < 0.05),随之略有回落,48 h时再次显著升高(P < 0.05),在肝胰腺变化不显著(P > 0.05);32℃时,其在鳃中变化基本不显著;在肝胰腺中24 h时表达量达到峰值,为对照组的2.38倍;34℃时,其在鳃中表达量8 h和24 h显著高于对照组(P < 0.05);在肝胰腺中表达量在4 h时显著低于对照组(P < 0.01),24 h达到峰值(图 3a1、a2)。
CTSL在鳃和肝胰腺中的变化趋势不同。30℃时,其在鳃中变化呈先下降再升高又下降的趋势,48 h时显著低于对照组(P < 0.01);在肝胰腺中变化不显著;32℃时,其在鳃中表达量在4 h开始降低,24 h时略有上调,但仍显著低于对照组(P < 0.01);在肝胰腺中12 h时表达量达到峰值;34℃时,其在鳃中变化呈先下降后上升再下降的趋势,48 h极显著低于对照组(P < 0.001);在肝胰腺中变化不显著(图 3b1、b2)。
CTL基因在鳃中未检测到有效信号。在肝胰腺中,其在30℃时变化不显著;在32℃时持续升高,48 h达到峰值,显著高于对照组(P < 0.001);34℃时其在48 h达到峰值,显著高于对照组(P < 0.05) (图 3c2)。
2.4 高温胁迫对细胞凋亡类基因mRNA表达的影响温度胁迫后,细胞凋亡基因在鳃中的表达与温度呈正相关,在肝胰腺中的表达随温度的升高总体呈先上升后下降的趋势(图 4)。
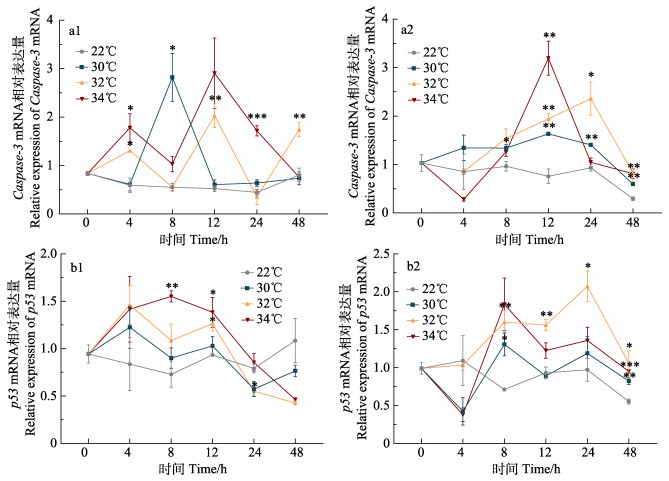
|
图 4 高温胁迫对缢蛏细胞凋亡相关基因表达的影响 Fig.4 Effects of high-temperature stress on the expression of apoptosis genes in S. constricta 1:鳃;2:肝胰腺 1: Gill; 2: Hepatopancreas |
30℃时,鳃和肝胰腺Caspase-3 mRNA分别在8 h和12 h时达到峰值,为对照组的5.11倍和2.15倍;32℃时,其在鳃和肝胰腺中表达量分别在4 h和8 h开始升高,12 h和24 h达到峰值,显著高于对照组(P < 0.05);34℃时,其在鳃和肝胰腺中表达量分别在4 h和8 h开始升高,均在12 h达到峰值,分别为对照组5.54倍和4.22倍(图 4a1、a2)。
30℃时,鳃和肝胰腺中p53 mRNA变化均不显著;32℃时,其在鳃中变化基本不显著;在肝胰腺中变化呈先升高后下降趋势,24 h时达到峰值,显著高于对照组(P < 0.05);34℃时,其在鳃中表达量8 h时显著高于对照组(P < 0.01),为对照组的2.13倍;在肝胰腺中8 h时表达量达到峰值,为对照组的2.58倍(图 4b1、b2)。
3 讨论高温胁迫下,机体通过调节体内相关酶和基因的表达以应对热应激。在水生生物中,鳃为主要的呼吸代谢器官,直接与海水接触,可直接感受水温的变化并迅速做出反应;肝胰腺为主要的代谢与免疫器官,对环境应激响应敏感。因此,本研究基于缢蛏高温胁迫后的转录组分析,筛选了3类高温应答相关基因,并对其在鳃和肝胰腺中的表达特征进行了分析。
3.1 分子伴侣类基因对高温胁迫的响应HSP作为主要的分子伴侣,在参与蛋白质折叠、组装、降解和细胞定位等方面发挥着重要作用(Liu et al, 2013; Kim et al, 2017)。在黄颡鱼(Pelteobagrus fulvidraco ♀ × Pelteobagrus vachelli ♂)中发现,高温可诱导HSP70的表达(朱凌威等, 2021)。研究表明,HSP上调可能是长牡蛎适应环境的关键(Zhang et al, 2012)。
热休克因子(HSF)是真核细胞中调控各类热激基因表达的主要蛋白因子。正常情况下,HSF1主要位于细胞质中,应激后转移到细胞核,与DNA上热休克元件(HSE)结合(Richter et al, 2010),激活HSP等靶基因转录,此时HSP释放HSF1,帮助变性蛋白质修复与降解(Richter et al, 2010; Jin et al, 2015)。在长牡蛎中发现,热应激可诱导HSF1和HSPs基因表达上调,且其中1个HSP70基因可能受到HSF1的调控,推测HSF1-HSP可能存在调控关系(Liu et al, 2019; Liu et al, 2020)。本研究中,高温胁迫后缢蛏HSF1和HSP70在初始阶段开始上调,且在鳃中表达与温度呈正相关,推测其可能通过激活HSF1促进HSP70合成,降解受损或错误折叠的蛋白。
BAG3作为分子伴侣,可与HSF1相互作用调节其核穿梭,进而调节HSP表达水平(Jin et al, 2015),也可通过调节细胞凋亡、发育、细胞骨架组织和自噬等调节细胞对应激的适应性反应(Behl, 2011; Gamerdinger et al, 2011)。本研究中,高温胁迫4 h后,BAG3 mRNA在鳃和肝胰腺中开始上调,其在贝类的研究中较少。热应激下,长牡蛎BAG蛋白家族通过与HSP70/HSC70直接作用调节其伴侣的功能(Lim et al, 2016);对缢蛏足转录组分析显示,高温胁迫下BAG3上调高达30倍(Zhang et al, 2019)。热应激后,缢蛏可能通过诱导BAG3上调激活HSF1,进而促进HSP合成以维持体内蛋白质稳态,抵御温度胁迫(Jin et al, 2015)。
此外,温度胁迫会导致内质网腔内错误折叠蛋白积累引起内质网应激,从而激活未折叠蛋白反应,引起应激基因(GRPs、CALR和PDIAs)上调(Tiffany-Castiglioni et al, 2012; Zhang et al, 2012)。PDIA6作为重要的分子伴侣之一,可抑制错误折叠蛋白的聚集;也可参与未折叠蛋白反应提高蛋白质折叠功能。长牡蛎热应激后血细胞中PDIA6表达量显著上调(Yang et al, 2017)。本研究中,温度胁迫可诱导缢蛏PDIA6上调,且在鳃中变化与温度呈正相关,与大菱鲆(Scophthalmus maximus)热胁迫后肝脏和肾脏中PDIA6基因表达模式一致(唐启政, 2018)。热应激下,缢蛏可能通过上调内质网内腔分子伴侣基因减少错误折叠蛋白的聚集,维持蛋白质质量控制。
3.2 细胞凋亡类基因对高温胁迫的响应细胞凋亡是生物体环境适应反应的重要机制,反映了机体对不同环境胁迫的适应能力。高温胁迫会引起细胞内DNA、蛋白质等大分子损伤,造成细胞凋亡,甚至死亡(Sheikh et al, 2015; Zhou et al, 2019)。热胁迫后,番红砗磲(Tridacna crocea)通过负调控未折叠蛋白反应诱导细胞凋亡(Zhou et al, 2019)。p53作为重要的抑癌因子,在细胞周期调控、细胞凋亡以及DNA损伤修复中发挥重要作用(Sheikh et al, 2015)。本实验中,胁迫初期,缢蛏p53基因表达量与温度呈正相关,推测机体通过上调p53基因修复损伤的细胞。随温度的持续升高和胁迫时间的延长,其表达受到抑制,可能是高温造成体内DNA不可修复,机体损伤严重,最终引起死亡,与暗纹东方鲀(Takifugu obscurus)和大菱鲆的变化趋势一致(Cheng et al, 2015; 刘晓菲等, 2019)。
Caspase-3作为细胞凋亡通路中关键的执行者,其表达量可反映细胞凋亡程度。本研究中,热应激后,缢蛏鳃和肝胰腺中Caspase-3变化呈先上升后下降的趋势,与暗纹东方鲀血细胞的结果基本一致(Cheng et al, 2015)。可能高温造成机体DNA损伤增加,进而影响其基因组完整性,启动下游细胞凋亡,使Caspase-3 mRNA表达水平增加(Yao et al, 2012)。在长牡蛎、凡纳滨对虾(Litopenaeus vannamei)和团头鲂(Megalobrama amblycephala)中也有类似发现(贾旭颖等, 2014; 孙盛明等, 2017; Yang et al, 2017),说明Caspase-3在缢蛏高温应激反应中发挥着重要作用。
4 结论急性高温胁迫下缢蛏应激相关基因在鳃和肝胰腺中表达变化的研究表明,缢蛏通过调节蛋白折叠、代谢、免疫以及细胞凋亡等一系列生物过程应对热应激。热激条件下,缢蛏可能上调分子伴侣类基因表达促进蛋白质折叠和恢复受损或降解变性的蛋白质,以维持体内蛋白质稳态。分子伴侣在修复或降解受损蛋白的同时,需要消耗大量ATP,机体通过加快代谢速率维持基本生命活动。随温度升高和胁迫时间延长,体内蛋白损伤程度不断加剧,代谢和免疫应答受到抑制。此时,机体通过激活凋亡系统清除体内受损细胞,进而维持细胞的稳态。本研究为进一步探索缢蛏高温响应分子机制奠定理论基础,同时为后续分子标记辅助育种提供候选基因。
BEHL C. BAG3 and friends: Co-chaperones in selective autophagy during aging and disease. Autophagy, 2011, 7(7): 795-798 DOI:10.4161/auto.7.7.15844 |
BRUN N T, BRICELJ V M, MACRAE T H, et al. Heat shock protein responses, in thermally stressed bay scallops, Argopecten irradians, and sea scallops, Placopecten magellanicus. Journal of Experimental Marine Biology and Ecology, 2008, 358(2): 151-162 DOI:10.1016/j.jembe.2008.02.006 |
CHENG C H, YANG F F, LIAO S A, et al. High temperature induces apoptosis and oxidative stress in pufferfish (Takifugu obscurus) blood cells. Journal of Thermal Biology, 2015, 53: 172-179 DOI:10.1016/j.jtherbio.2015.08.002 |
CHENG D W, LIU H X, ZHANG H K, et al. Effects of thermal stress on mortality and HSP90 expression levels in the noble scallops Chlamys nobilis with different total carotenoid content. Cell Stress and Chaperones, 2020, 25(1): 105-117 DOI:10.1007/s12192-019-01052-5 |
DONG Y H, ZENG Q F, REN J F, et al. The chromosome-level genome assembly and comprehensive transcriptomes of the razor clam (Sinonovacula constricta). Frontiers in Genetics, 2020, 11: 664 DOI:10.3389/fgene.2020.00664 |
GAMERDINGER M, KAYA A M, WOLFRUM A, et al. BAG3 mediates chaperone-based aggresome-targeting and selective autophagy of misfolded proteins. EMBO Reports, 2011, 12(2): 149-156 DOI:10.1038/embor.2010.203 |
HAO Z L, TANG X J, DING J, et al. Effect of high temperature on survival, oxygen consumption, behavior, ammonia-N excretion, and related immune indicators of the Japanese scallop Mizuhopecten yessoensis. Aquaculture International, 2014, 22(6): 1863-1876 DOI:10.1007/s10499-014-9788-0 |
JIA X Y, ZHANG D, LU Y L, et al. Effects of abrupt change in temperature and non-ionic ammonia on the cyt-C and caspase-3 of Litopenaeus vannamei in freshwater. Journal of Fishery Sciences of China, 2014, 21(4): 700-710 [贾旭颖, 张丹, 路允良, 等. 温度突变和非离子氨胁迫对淡水养殖凡纳滨对虾cyt-C和caspase-3的影响. 中国水产科学, 2014, 21(4): 700-710] |
JIANG W W, MEIRONG D, FANG J. Response of Yesso scallop Patinopecten yessoensis to acute temperature challenge: Physiological and biochemical parameters. Journal of Oceanology and Limnology, 2019, 37: 321-329 DOI:10.1007/s00343-019-7245-7 |
JIN Y, AHN S, KIM S. BAG3 affects the nucleocytoplasmic shuttling of HSF1 upon heat stress. Biochemical and Biophysical Research Communications, 2015, 464(2): 561-567 DOI:10.1016/j.bbrc.2015.07.006 |
KIM B M, KIM K, CHOI I Y, et al. Transcriptome response of the Pacific oyster, Crassostrea gigas susceptible to thermal stress: A comparison with the response of tolerant oyster. Molecular and Cellular Toxicology, 2017, 13(1): 105-113 DOI:10.1007/s13273-017-0011-z |
LIM H J, KIM B M, HWANG I J, et al. Thermal stress induces a distinct transcriptome profile in the Pacific oyster Crassostrea gigas. Comparative Biochemistry and Physiology Part D Genomics and Proteomics, 2016, 19: 62-70 DOI:10.1016/j.cbd.2016.06.006 |
LIU D, CHEN Z. The expression and induction of heat shock proteins in molluscs. Protein and Peptide Letters, 2013, 20(5): 602-606 DOI:10.2174/0929866511320050014 |
LIU X F, MA A J, HUANG Z H, et al. Expression characteristics analysis of major QTL candidate genes in response to high temperature stress in turbot (Scophthalmus maximus). Journal of Fisheries of China, 2019, 43(6): 1407-1415 [刘晓菲, 马爱军, 黄智慧, 等. 大菱鲆高温胁迫应答主效QTL候选基因的表达特性分析. 水产学报, 2019, 43(6): 1407-1415] |
LIU Y, LI L, HUANG B, et al. RNAi based transcriptome suggests genes potentially regulated by HSF1 in the Pacific oyster Crassostrea gigas under thermal stress. BMC Genomics, 2019, 20(1): 639-654 DOI:10.1186/s12864-019-6003-8 |
LIU Y, ZHU Q, LI L, et al. Identification of HSF1 target genes involved in thermal stress in the Pacific oyster Crassostrea gigas by ChIP-seq. Marine Biotechnology, 2020, 22(9): 167-179 |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR. Methods, 2002, 25(4): 402-408 |
Lü X N, WANG X Q, WU Y L, et al. Effect of temperature on the energy budget of Arcuatula senhousei. Progress in Fishery Sciences, 2018, 39(4): 119-125 [吕旭宁, 王晓芹, 吴亚林, 等. 温度对凸壳肌蛤能量收支的影响. 渔业科学进展, 2018, 39(4): 119-125] |
NIE H T, LIU L H, HUO Z M, et al. The HSP70 gene expression responses to thermal and salinity stress in wild and cultivated Manila clam Ruditapes philippinarum. Aquaculture, 2017, 470: 149-156 DOI:10.1016/j.aquaculture.2016.12.016 |
RICHTER K, HASLBECK M, BUCHNER J, et al. The heat shock response: Life on the verge of death. Molecular Cell, 2010, 40(2): 253-266 DOI:10.1016/j.molcel.2010.10.006 |
SHEIKH M S, FORNACE A J. Role of p53 family members in apoptosis. Journal of Cellular Physiology, 2015, 182(2): 171-181 |
SUN S M, ZHU J, GE X P, et al. Cloning of caspase3 gene in Megalobrama amblycephala and analysis of its expression in high temperature stress. Genomics and Applied Biology, 2017, 36(10): 4090-4099 [孙盛明, 朱健, 戈贤平, 等. 团头鲂(Megalobrama amblycephala) caspase3基因克隆及其在高温胁迫中的表达分析. 基因与基因组学, 2017, 36(10): 4090-4099] |
TANG Q Z. Cloning, expression and function of stress-resistant genes based on the transcriptome of turbot (Scophthalmus maximus) skin tissue. Master´s Thesis of Shanghai Ocean University, 2018 [唐启政. 基于大菱鲆皮肤组织转录组的抗逆基因克隆、表达及功能研究. 上海海洋大学硕士研究生学位论文, 2018]
|
TIFFANY-CASTIGLIONI E, QIAN Y. ER chaperone-metal interactions: Links to protein folding disorders. NeuroToxicology, 2012, 33(3): 545-557 DOI:10.1016/j.neuro.2012.02.007 |
UGALDE S C, PRESTON J, OGIER E, et al. Analysis of farm management strategies following herpesvirus (OsHV-1) disease outbreaks in Pacific oysters in Tasmania. Australia Aquaculture, 2018, 495: 179-186 |
WANG R C, WANG Z P. Science of marine shellfish cutlure. Qingdao: China Ocean University Press, 2008 [王如才, 王昭平. 海水贝类养殖学. 青岛: 中国海洋大学出版社, 2008]
|
XUE B B, MENG D L, REN S Y, et al. ScHsc70 gene SNP markers screening and correlation analysis for high temperature resistance of Sinonovacula constricta new variety "Shenzhe No. 1". Journal of Fisheries of China, 2019, 43(12): 2439-2448 [薛宝宝, 孟德龙, 任泓妤, 等. 缢蛏新品种"申浙1号"ScHsc70基因SNPs筛查与耐高温性状的关联性分析. 水产学报, 2019, 43(12): 2439-2448] |
XUE S Y, WANG J Y, LI J Q, et al. Effects of temperature on energy metabolism and antioxidant enzyme activities of Scapharca broughtonii. Journal of Fisheries of China, 2019, 43(3): 573-583 [薛素燕, 王金叶, 李家琦, 等. 温度对魁蚶能量代谢及抗氧化酶活性的影响. 水产学报, 2019, 43(3): 573-583] |
YANG C, GAO Q. The transcriptional response of the Paci?c oyster Crassostrea gigas against acute heat stress. Fish and Shell?sh Immunology, 2017, 68(1): 132-143 |
YAO C L, SOMERO G N. The impact of acute temperature stress on hemocytes of invasive and native mussels (Mytilus galloprovincialis and Mytilus californianus): DNA damage, membrane integrity, apoptosis and signaling pathways. Journal of Experimental Biology, 2012, 215(24): 4267-4277 |
YU J H, SONG J H, CHOI M C, et al. Effects of water temperature change on immune function in surf clams, Mactra veneriformis (Bivalvia: Mactridae). Journal of Invertebrate Pathology, 2009, 102(1): 30-35 DOI:10.1016/j.jip.2009.06.002 |
ZHANG D, WANG H W, YAO C L. Molecular and acute temperature stress response characterizations of caspase-8 gene in two mussels, Mytilus coruscus and Mytilus galloprovincialis. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2014, 177/178: 10-20 DOI:10.1016/j.cbpb.2014.08.002 |
ZHANG G, FANG X, GUO X, et al. The oyster genome reveals stress adaptation and complexity of shell formation. Nature, 2012, 490(7418): 49-54 DOI:10.1038/nature11413 |
ZHANG W, STOREY K B, DONG Y W. Adaptations to the mudflat: Insights from physiological and transcriptional responses to thermal stress in a burrowing bivalve Sinonovacula constricta. Science of the Total Environment, 2019, 710: 136280 |
ZHOU Z, LIU Z, WANG L, et al. Oxidative stress, apoptosis activation and symbiosis disruptionin giant clam Tridacna crocea under high temperature. Fish and Shellfish Immunology, 2019, 84: 451-457 DOI:10.1016/j.fsi.2018.10.033 |
ZHU L W, ZHANG C Y, LIU Z, et al. Cloning, expression of hsp70 core cDNA and the effects of heat stress on its tissue expression in Pelteobagrus fulvidraco ♀× P. vachelli ♂. Progress in Fishery Sciences, 2021, 42(1): 47-55 [朱凌威, 张朝阳, 刘钊, 等. 杂交黄颡鱼hsp70基因核心序列的克隆、表达及其在高温应激下的组织表达. 渔业科学进展, 2021, 42(1): 47-55] |
ZHU Q, ZHANG L, LI L, et al. Expression characterization of stress genes under high and low temperature stresses in the Pacific oyster, Crassostrea gigas. Marine Biotechnology, 2016, 18(2): 176-188 DOI:10.1007/s10126-015-9678-0 |



