2. 沂南县水利局 山东 临沂 276300;
3. 山东省海洋生物研究院 山东 青岛 266104;
4. 山东寰达生态环境科技有限公司 山东 日照 276826
2. Yi′nan County Water Conservancy Bureau, Linyi, Shandong 276300, China;
3. Marine Biology Institute of Shandong Province, Qingdao, Shandong 266104, China;
4. Shandong Huanda Ecological Environment Technology Co. LTD, Rizhao, Shandong 276826, China
海水鱼类池塘高密度养殖条件下,以N、P为主的污染性代谢产物容易积累,一旦超过养殖池塘自身净化能力,将导致养殖鱼类、微生物和环境三者所构成的动态平衡状态的失调,极易暴发各种疾病。在我国大力推行绿色养殖的背景下,对待水产生物疾病的主要措施从以“治疗”为主逐渐转变为以“防控”为主,因此,益生菌及其制剂、疫苗等生物防治方式备受关注(丁贤等, 2004; Merrifield et al, 2010; Luis-Villaseñor et al, 2011; Buruiană et al, 2014; 徐奇友等, 2017)。益生菌制剂主要通过微生物的生态调控作用有效抑制外源菌群的入侵以维持生态环境内菌群的动态平衡,实现无机氮、磷等污染物质的降解、转化和再利用,构建良性循环的养殖生态系统。
目前,水产养殖领域常用的益生菌包括光合细菌、芽孢杆菌、硝化细菌、乳酸菌、EM菌等,以单一或复合添加的方式应用于养殖环境的调控(丁贤等, 2004; Buruiană et al, 2014)。芽孢杆菌和乳酸菌是应用较为广泛的一类益生菌,合理使用可以有效改善养殖水环境质量,并维持养殖水生动物消化道微生物的生态平衡,提高养殖动物消化和免疫能力,促进动物生长(Merrifield et al, 2010; Luis-Villaseñor et al, 2011; 徐奇友等, 2017)。在鱼类养殖应用方面,已有研究表明,芽孢杆菌在调控养殖水质(李健等, 2001; Fu et al, 2017; 张翠绵等, 2017)、促进养殖鱼类生长(华雪铭等, 2001; Merrifield et al, 2010; Liu et al, 2012; 徐奇友等, 2017)和调控养殖鱼类肠道菌群(Jiang et al, 2019b)等方面都起到了较好的效果。目前,国内外利用益生菌等进行海水鱼类池塘养殖方面的应用研究较少。
本团队前期研制了一种益生菌制剂,发现其能有效降解池塘养殖水体中的氨氮、亚硝酸盐和磷酸盐(李存玉等, 2017)。本研究应用该益生菌制剂对池塘养殖牙鲆(Paralichthys olivaceus)肠道和环境菌群结构进行调控,以期揭示养殖水体和底泥沉积物以及肠道中的微生物群落变化规律与益生菌制剂调控的关系,为开发牙鲆池塘高密度养殖专用益生菌制剂和环境微生态调控技术提供理论支撑。
1 材料与方法 1.1 实验管理益生菌制剂添加实验于2013年9—10月在山东省日照市水利养殖场(35.29°N, 119.44°E)进行,选择面积同为3300 m2,且同为泥沙底质的2口养殖池塘,水深为2.0 m,分别设为实验组和对照组。池塘内养殖牙鲆平均体重为(282.0±24.23) g,平均体长为(28.3± 1.93) cm,养殖密度均为4.5尾/m2。以鲜杂鱼为饵料,每天投喂2次,投喂量为养殖鱼体重的3%~5%,每天换水50%。实验期间,池塘养殖水体的水质指标:水温为21℃~23℃,盐度为27~29,溶解氧(DO)≥5 mg/L,pH为7.8~8.7。
实验所使用的益生菌制剂为本实验室与日照市生态环境研究所联合制备的产品,主要成分为肠杆菌属(Enterobacter)、芽孢乳杆菌属(Sporolactobacillus)、乳杆菌属(Lactobacillus)等有益微生物,有效活菌数不低于1.0×109 CFU/g。在前期预实验的基础上制定益生菌制剂的施用策略:按照池塘水体1.0×105 CFU/mL的添加量全池泼洒,每天上午添加1次,下午换水后补充1次,连续添加10 d,在第11~15天继续追踪相关数据,实验共持续15 d;实验期间,对照池塘不添加益生菌制剂,只追踪相关数据。
1.2 样品采集在实验第1天添加益生菌制剂前、添加益生菌制剂后(第5、10、15天)分别对2个池塘的水体、底泥和养殖鱼肠道进行样品采集,分析样品中微生物菌群结构的变化。每次在上午投喂前,完成各种生物样本的采集,采集方法如下:
肠道样品:每次随机捞取6尾体表无任何生理学病症的健康牙鲆,采用MS-222 (Fluka, 美国)麻醉后置于冰上,无菌条件下解剖,取其完整肠道,轻轻挤出肠道内残留的食糜,用预冷的无菌水冲洗肠道数次,分装于无菌离心管中,并迅速放入液氮中保存。
底泥样品:用采泥器采集池塘底泥,采集点分别位于进水口、排水口和增氧机附近,每处采集3次样品,将采集的每个池塘的底泥样品充分混匀,并分装于无菌离心管中,立即放入液氮中保存。
养殖水样:用透明的卡盖式采水器采集池塘水样,分别于池塘进水口、排水口和增氧机附近采集中层水样,每处采集3次样品,将采集的每个池塘的水样充分混匀,混匀后水样保留3 L,经0.22 μm的滤膜真空抽滤后,将滤膜置于无菌离心管中,放入液氮保存。
饵料样品:实验期间,投喂的鲜杂鱼为购买的同批货源,使用无菌器械从中随机取完整鱼体5~8尾(全长为10 cm左右),无菌条件下剪成小段,液氮速冻后研磨成粉状,充分混匀并平均分装于无菌离心管中,液氮保存。
实验期间,将每次采集的样品进行编号、分类保存,具体采样时间与分类编号情况见表 1。
|
|
表 1 样品采集统计表 Tab.1 Samples collected for microbiota structure analysis |
将样本从液氮中取出,其中,肠道样本在液氮条件下研磨,每个池塘的6个平行样本充分混匀,取一小部分样品按照土壤微生物DNA提取试剂盒(OMEGA, 美国)说明书进行微生物总DNA提取;其余样本置于冰上自然解冻后,参照说明书提取微生物总DNA。针对微生物16S rDNA V3~V4可变区设计含barcode的特异引物(338F:5′-ACTCCTACGGGAGGC AGCA-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′),并进行PCR扩增。PCR产物经琼脂糖凝胶电泳检测合格后,使用AxyPrep DNA凝胶回收试剂盒(Axygen, 美国)切胶回收PCR产物,并构建测序文库,采用Miseq平台进行高通量测序。
1.4 测序数据生物信息学分析高通量测序数据的分析:利用uparse (version 7.1 http://drive5.com/uparse/)软件平台对处理后的序列进行聚类操作,采用RDP classifier (v2.2)对相似水平高于97%的可操作分类单元(operational taconomic units, OTU)代表序列进行归类分析,并在各个水平上统计每个样品的群落组成;利用Mothur (version v.1.30.1 http://www.mothur.org/wiki/Schloss_SOP#Alpha_ diversity)进行稀释性曲线分析;分别利用香农指数(Shannon)和物种丰富度指数(ACE)评估微生物多样性;利用R语言进行主成分分析。利用Excel 2016软件对菌群多样性和相对丰度进行统计分析。
2 结果与分析 2.1 样品微生物多样性水平分析通过高通量测序与分析,平均每个样本获取15 400条有效序列,结合稀释性曲线可以看出,实验样品的测序结果是可靠的(图 1)。各样品中微生物多样性由高到低依次为池塘底泥、牙鲆肠道、池塘水样、饵料、益生菌制剂。其中,池塘底泥样品的香农指数为4.96、物种丰富度指数为746,均为最高值,说明微生物多样性最高;同时,随着实验的开展,池塘底泥样品的香农指数和物种丰富度指数均呈先下降后上升的趋势,第15天的多样性指数均高于第1天。池塘水体中的微生物多样性呈先下降后上升的趋势,而肠道中微生物多样性的变化较大,整体呈上升趋势。益生菌制剂样品的香农指数和物种丰富度指数分别为1.64和80.7,均为最低值,说明微生物多样性最低(图 2)。
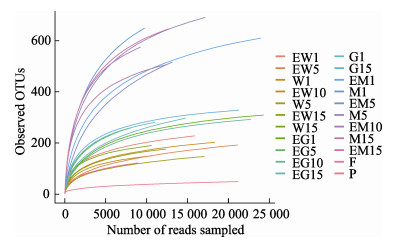
|
图 1 实验样品菌群稀释性曲线 Fig.1 Rarefaction curve of microbiota in all samples |
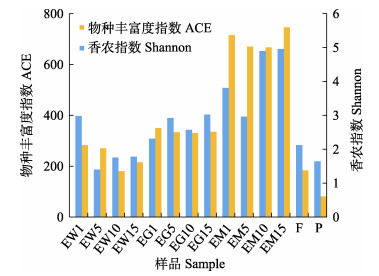
|
图 2 基于16S rDNA基因序列的微生物多样性指数 Fig.2 Microbiota diversity index based on 16S rDNA gene sequences |
在门水平上,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和梭杆菌门(Fusobacteria)为牙鲆肠道主要的优势菌群,随着实验地进行,变形菌门、厚壁菌门相对丰度增大,梭杆菌门则相反(图 3)。蓝藻门(Cyanophyta)、拟杆菌门(Bacteroidetes)和变形菌门为养殖池塘水体中主要菌群,添加益生菌制剂后,蓝藻门相对丰度先上升后下降,与拟杆菌门相对丰度变化完全相反,变形菌门相对丰度则逐渐下降。变形菌门和厚壁菌门为池塘底泥的主要优势菌群,随着实验地进行,变形菌门呈先下降后上升的趋势,而厚壁菌门则相反。
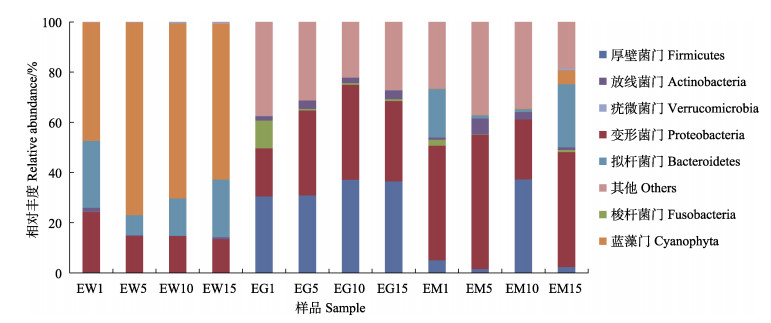
|
图 3 实验过程中水体、牙鲆肠道和底泥样品中的优势菌门 Fig.3 Dominant phyla in culture water, intestinal tract and pond sediment during the experiment |
在属水平中,益生菌制剂中芽孢乳杆菌属、肠杆菌属、乳杆菌属为主要的菌群(图 4)。池塘养殖牙鲆肠道样品中,随着实验地进行,芽孢杆菌属(Bacillus)、肠杆菌属的相对丰度逐渐升高,在第15天时,仍可检测到肠杆菌属;军团杆菌属(Legionella)相对丰度由2.95%增加到7.19%,不动杆菌属(Acinetobacter)、发光杆菌属(Photobacterium)和弧菌属(Vibrio)相对丰度呈先上升后下降的趋势。池塘养殖水体中的NS3a_marine_group相对丰度先下降后上升。池塘底泥中,芽孢杆菌属的相对丰度在添加益生菌制剂的第10天,由最初的3.78%增加到33.64%,之后明显下降;脱硫叠球菌属(Desulfosarcina)由最初的3.34%先下降后迅速增加到8.62%;不动杆菌属相对丰度在添加益生菌制剂的第5天,由最初的0.01%增加到13.15%,随后大幅下降,至第15天时检测不到;Marinicella相对丰度由10.95%先下降,再上升至2.87%。牙鲆肠道、养殖水体和底泥中的弧菌属相对丰度均呈现不同程度的下降趋势。另外,在添加益生菌制剂的第5天,检测到底泥样品中出现肠杆菌属(0.11%),第10天相对丰度为0.05%,但在第15天(停止添加益生菌的第5天)时,底泥样品中检测不到肠杆菌属。
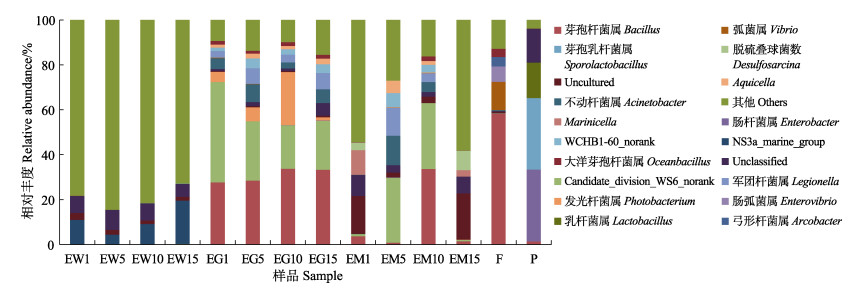
|
图 4 实验过程中各样品中优势菌属结构特征 Fig.4 Dominant genera in all kinds of samples during the experiment |
实验过程中,对照池塘养殖牙鲆肠道优势菌属中Candidate_division_WS6-norank代表的菌属相对丰度降低了40.98%,芽孢杆菌属相对丰度相对稳定,发光杆菌属、不动杆菌属、军团杆菌属等优势菌属的相对丰度分别提高35.46%、64.05%和134.58% (图 5Ⅰ)。实验开始时,实验池塘和对照池塘水体中的优势菌属组成结构相近,随着实验地进行,对照池塘水体中优势菌属的相对丰度变化较大,其中,NS3a_marine_ group、假交替单胞菌属(Pseudoalteromonas)、交替单胞菌属(Alteromonas)的相对丰度变化较为明显,整体呈先下降后上升的趋势(图 5Ⅱ)。同样,实验开始时,实验池塘和对照池塘底泥中的优势菌属组成结构相近,随着实验地进行,池塘底泥中Marinicella、芽孢杆菌属、Candidate_division_WS6_norank等相对丰度变化较为明显,其中,Marinicella的相对丰度先上升后下降,而芽孢杆菌属则完全相反(图 5Ⅲ)。
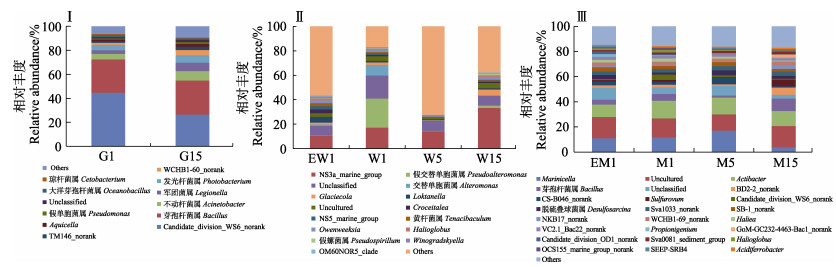
|
图 5 对照组牙鲆肠道G1与G15(Ⅰ)、池塘水(Ⅱ)、和底泥(Ⅲ)优势菌属结构特征 Fig.5 Structure of the dominant genera of intestinal tracts G1 and G15 (Ⅰ), culture water (Ⅱ) and pond sediment (Ⅲ) in the control group |
通过主成分分析(PCA)可以看出,主成分1 (PC1)的贡献率为55.98%,远高于主成分2 (PC2)的22.97%;牙鲆肠道样品与饵料、底泥间的距离更为相近,说明肠道中的菌群组成与饵料和底泥的相似;同时,与池塘水体相比,池塘底泥样品与益生菌产品更为相近,说明益生菌产品对池塘底泥微生物组成影响较大(图 6)。
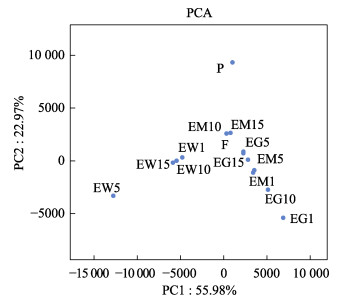
|
图 6 不同样品主成分分析 Fig.6 Principal components analysis (PCA) of different samples |
在属水平上,通过对各样品中菌群的组成与丰度信息进行分析,可以看出,牙鲆肠道样品与饵料和底泥中的菌群组成更为相近,其次是水环境样本,而益生菌制剂与牙鲆肠道菌群组成相似性最小(图 7)。但益生菌制剂与底泥和水环境中菌群组成较为相近。说明益生菌产品对除饵料外的牙鲆养殖环境中的菌群影响较大。
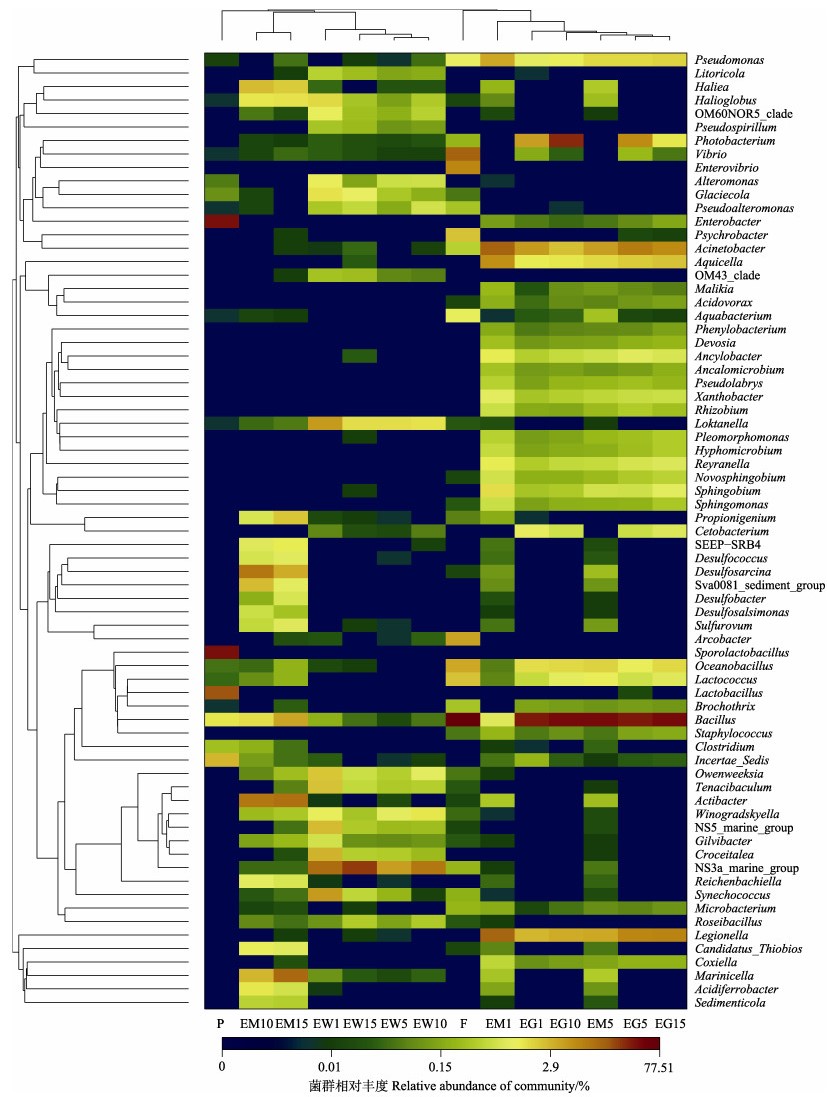
|
图 7 基于菌群相对丰度的Heatmap Fig.7 Heatmap of relative abundances of microbiota |
微生物多样性指数显示,在添加益生菌制剂以后,池塘水样和底泥样品微生物多样性呈先下降后升高的趋势,养殖环境中菌群结构也发生了明显的改变,这与王新等(2014)对微生态制剂改善虾池水质及微生物群落的研究结果一致。添加益生菌制剂初期,池塘水体和底泥中微生物多样性降低,一方面可能是添加的菌种大量繁殖,抑制了某些定植菌的生长(张睿等, 2014);另一方面可能是添加的益生菌虽然本身繁殖数量有限,但可直接或间接的导致某些定植菌成为优势菌,并抑制某些丰度极低的定植菌生长繁殖,改变原有的菌群结构,导致微生物多样性降低。在菌群结构与组成信息方面,实验中施用的益生菌制剂主要由肠杆菌属和乳杆菌属等组成,然而,这些菌属在养殖牙鲆池塘水体和底泥中检出量极低(图 4),表明前期微生物多样性下降的原因应为后者。添加益生菌制剂后期,池塘系统通过自我调节作用,使得菌群结构维持在一个新的平衡状态,微生物多样性升高。牙鲆肠道样品中微生物多样性相对比较稳定,这可能是因为相对于池塘水体和底泥,肠道为其定植微生物提供了一个相对封闭的微生态环境,通过宿主的生理功能,使肠道菌群具有能维持其定植后平衡状态的内在机制,可抵御外部环境对其菌群结构造成的影响。
3.2 牙鲆肠道和环境菌群结构变化分析本研究显示,添加益生菌制剂后,池塘水体中蓝藻门细菌相对丰度增加,蓝细菌是能进行光合作用的大型原核微生物,其相对丰度的增加在一定程度上提高了养殖水体中DO的含量,能有效降低高密度集约化养殖条件下因缺氧引起的生产风险。池塘底泥中芽孢杆菌属的变化最为明显,其相对丰度的增加有助于提高养殖鱼对饵料的利用率及其生长性能(Bairagi et al, 2004);添加益生菌制剂期间,底泥中能检测到肠杆菌属,停止添加益生菌制剂后检测不到肠杆菌属菌群,研究表明,底泥中的肠杆菌属来自添加的益生菌制剂(图 4),之后经分离鉴定发现,其为产气肠杆菌(Enterobacter aerogenes)(待发表)。关于产气肠杆菌的研究既有其致病性方面的报道(徐风亮等, 2007),也有关于其通过发酵生产有用生物衍生品[乳酸、生物氢、多羟基烷酸酯(PHA)、鼠李糖酯等]、降低发酵成本等方面的报道(徐忠义等, 2011; Arumugam et al, 2014、2020; Song et al, 2020)。不动杆菌属在医学界被认为是重要的病原菌(Lynch et al, 2017; Wong et al, 2017);在鱼类养殖中也分离得到一些不动杆菌属的菌株(A. baumannii、A. lwoffii、A. pittii和A. Schindleri等),并且其中的某些致病种类能够耐受多种药物(Reddy et al, 2013; Kozińska et al, 2014; Li et al, 2017)。弧菌属中的大部分菌株在水产养殖中被认为是常见的病原菌(Baker-Austin et al, 2018; 胡秀彩等, 2019)。本研究中,对照池塘牙鲆肠道中弧菌属、不动杆菌属等相对丰度明显升高,而这些菌属相对丰度在实验池塘牙鲆肠道中则出现一定程度的降低;同时,实验池塘牙鲆肠道中的中肠杆菌属相对丰度升高。这可能是因为益生菌制剂中的部分微生物虽然不能在肠道中成功定植,但是,它们能通过产物抑制等作用一定程度调控肠道菌群的稳态;并且能在肠道中定植的部分益生菌通过营养竞争、粘附位点竞争等模式有效抑制有害菌的繁殖。虽然牙鲆肠道内定植有弧菌、不动杆菌等多种病原菌,并且实验过程中不动杆菌属的相对丰度在一定阶段内有所升高,但鱼体始终未出现任何病症,活力也非常好,说明健康鱼体内有病原菌的存在属正常现象(Reddy et al, 2013; Jiang et al, 2019a; 姜燕等, 2020)。在正常鱼体的生理活动中,这些病原菌的丰度在安全范围内,并且鱼体内的微生态处于平衡状态。在添加益生菌制剂期间,养殖鱼肠道内能检测到乳杆菌,但其在牙鲆肠道中的相对丰度小、变化不稳定,而肠杆菌属相对丰度升高,反应出定植菌(肠杆菌属)和外源菌(乳杆菌属)在肠道中相对丰度变化的本质区别,也表明肠道菌群具有维持其定植后平衡状态的本质。Skjermo等(2015)将从大西洋鳕鱼(Gadus morhua)肠道内分离得到的益生菌通过水和饵料2种途径进行添加,结果均未在鳕鱼肠道内检测到该菌。Jiang等(2019b)以生物饵料为载体进行大菱鲆(Scophthalmus maximus)幼鱼源益生菌的添加,发现益生菌虽未在大菱鲆仔稚幼鱼消化道中成功定植,但其益生作用却成功传递到了仔稚幼鱼消化道中。同样,在本研究中,虽然益生菌制剂中的部分菌群未能在池塘各个容纳体(牙鲆、水和底泥)中成功定植,但它们优化菌群结构的“益生”功能却得以有效传递。再者,益生菌制剂中肠杆菌属的部分菌株为亚硝化反硝化聚磷菌,被广泛应用于废水处理(张立成等, 2012)。可能也正是由于益生菌或其制剂的“益生”作用,一方面改善牙鲆肠道菌群结构,一定程度促进饲料蛋白营养的有效利用,降低N、P排放;另一方面,益生菌本身参与到池塘养殖环境中N、P的降解过程,最终使得池塘水体中N、P化合物(氨氮、磷酸盐等)的浓度得到有效降解。本研究认为,一定浓度的益生菌制剂能直接或间接的影响鱼体肠道和池塘环境中菌群结构,改善养殖环境质量,短期效果明显,在投喂饵料没有改变的情况下,可加强养殖环境对牙鲆的影响,引起牙鲆肠道菌群结构的改变,促进牙鲆健康生长。
益生菌制剂对水产养殖动物的调控是一个复杂的过程。本研究中,对照组池塘水环境菌群结构变化较大,但改变属于自然水体的正常波动,而实验组池塘水体中的优势菌属的组成在整个实验过程中相对比较稳定,说明益生菌制剂的施用有助于养殖水环境微生物群结构的统一与稳定。对照组池塘底泥中的菌群结构相对比较稳定,而施用益生菌制剂后底泥中菌群结构变化较明显,尤其是芽孢杆菌属、脱硫叠球菌属等相对丰度的迅速变化,表明益生菌制剂对池塘底泥菌群具有一定的调控作用。对照组池塘养殖牙鲆肠道菌群结构也出现一定程度的变动,也表明了牙鲆肠道定植菌群结构虽然会同环境菌群一起出现波动,但是这些波动在平衡状态的范围之内,反映了肠道对其定植菌群平衡状态的维护功能;实验组池塘养殖牙鲆肠道菌群结构的动态变化表明了益生菌制剂的重要调控作用。本研究设置了对照组的横向比较及实验组添加益生菌制剂前后的纵向比较,使数据具有说服力,通过对牙鲆肠道及生长环境中微生物种类、数量变化及相关影响因子的测定,初步分析了益生菌制剂对池塘养殖牙鲆肠道菌群的调控机制。可能正是由于这种调控作用,使养殖牙鲆对饵料的消化吸收能力得以提高,从而排放到养殖水体中的氨氮、亚硝酸盐等的含量减少,促进水产绿色养殖的发展。对于益生菌制剂调控过程中,池塘养殖牙鲆消化和免疫等理化因子的应答变化及机制是今后研究的重点内容,将从多角度综合解析益生菌制剂的调控机制。
ARUMUGAM A, FURHANA S M. Bioconversion of Calophyllum inophyllum oilcake for intensification of rhamnolipid and polyhydroxyalkanoates co-production by Enterobacter aerogenes. Bioresource Technology, 2020, 296: 122321 DOI:10.1016/j.biortech.2019.122321 |
ARUMUGAM A, SANDHYA M, PONNUSAMI V. Biohydrogen and polyhydroxyalkanoate co-production by Enterobacter aerogenes and Rhodobacter sphaeroides from Calophyllum inophyllum oil cake. Bioresource Technology, 2014, 164: 170-176 DOI:10.1016/j.biortech.2014.04.104 |
BAIRAGI A, SARKAR GHOSH K, SEN S K, et al. Evaluation of the nutritive value of Leucaena leucoeephala leaf meal, inoculated with fish intestinal bacteria Bacillus subtilis and Bacillus circulans in formulated diets for rohu, Labeo rohita (Hamilton) fingerlings. Aquaculture Research, 2004, 35: 436-446 DOI:10.1111/j.1365-2109.2004.01028.x |
BAKER-AUSTIN C, OLIVER J D, ALAM M, et al. Vibrio spp. infections. Nature Reviews Disease Primers, 2018, 4(1): 1-19 |
BURUIANĂ C T, PROFIR A G, VIZIREANU C. Effects of probiotic Bacillus species in aquaculture-An overview. Annals of the University Dunarea de Jos of Galati Fascicle Ⅵ-Food Technology, 2014, 38(2): 9-17 |
DING X, LI Z J, CHEN Y Q, et al. Effects of probiotics on growth and activities of digestive enzymes Pennaus vannamei. Journal of Fishery Sciences of China, 2004, 11(6): 580-584 [丁贤, 李卓佳, 陈永青, 等. 芽孢杆菌对凡纳对虾生长和消化酶活性的影响. 中国水产科学, 2004, 11(6): 580-584 DOI:10.3321/j.issn:1005-8737.2004.06.017] |
FU G, RUAN B, ZHU J, et al. Nutritional conditions for application of Bacillus in Intensive aquaculture of shrimp. Agricultural Science and Technology, 2017, 18(6): 1029-1032 |
HU X C, WANG Y J, LÜ A J, et al. Isolation and identification of Vibrio vulnificus from Cynoglossus semilaevis and establishment of fluorescence quantitative PCR technique. Journal of Fisheries of China, 2019, 43(5): 1359-1368 [胡秀彩, 王英杰, 吕爱军, 等. 半滑舌鳎创伤弧菌分离鉴定及其荧光定量PCR方法的建立. 水产学报, 2019, 43(5): 1359-1368] |
HUA X M, ZHOU H Q, QIU X Z, et al. Effects of dietary Bacillus sp. and selenoyeast on the growth and diease resistance of allogynogenetic crucian carp. Journal of Fisheries of China, 2001, 25(5): 448-453 [华雪铭, 周洪琪, 邱小琮, 等. 饲料中添加芽孢杆菌和硒酵母对异育银鲫的生长及抗病力的影响. 水产学报, 2001, 25(5): 448-453] |
JIANG Y, LIU Z, LIU X, et al. Structural characteristics and succession of intestinal microbiota for Paralichthys olivaceus during the early life stage. Aquaculture Research, 2019a, 50: 529-540 DOI:10.1111/are.13924 |
JIANG Y, WANG Y, ZHANG Z, et al. Responses of microbial community structure in turbot (Scophthalmus maximus) larval intestine to the regulation of probiotic introduced through live feed. PLoS ONE, 2019b, 14(5): e0216590 DOI:10.1371/journal.pone.0216590 |
JIANG Y, XU Y J, YU C Y, et al. Analysis of microbiota structure, digestive enzyme and nonspecific immune enzyme activity in the gastrointestinal tract of large yellow croaker. Progress in Fishery Sciences, 2020, 41(5): 61-72 [姜燕, 徐永江, 于超勇, 等. 大黄鱼消化道菌群结构、消化酶和非特异性免疫酶活力分析. 渔业科学进展, 2020, 41(5): 61-72] |
KOZIŃSKA A, PAŹDZIOR E, PĘKALA A, et al. Acinetobacter johnsonii and Acinetobacter lwoffii-the emerging fish pathogens. Bulletin of the Veterinary Institute in Pulawy, 2014, 58: 193-199 DOI:10.2478/bvip-2014-0029 |
LI C Y, LIU X Z, XU Y J, et al. Isolation, culture, and identification of two strains of probiotics and their effects on water quality control. Progress in Fishery Sciences, 2017, 38(1): 120-127 [李存玉, 柳学周, 徐永江, 等. 两株有益菌的分离、培养、鉴定及其水质调控效果评价. 渔业科学进展, 2017, 38(1): 120-127] |
LI J, CAO J, WANG X, et al. Acinetobacter pittii, an emerging new multi-drug resistant fish pathogen isolated from diseased blunt snout bream (Megalobrama amblycephala Yih) in China. Applied Microbiology and Biotechnology, 2017, 101: 6459-6471 DOI:10.1007/s00253-017-8392-4 |
LI J, SUN X T, WANG Q, et al. Studies on the effects of probiotics in Crustacean's farming. Marine Fisheries Research, 2001, 22(2): 26-31 [李健, 孙修涛, 王群, 等. 微生态制剂在甲壳动物养殖中的应用研究. 海洋水产研究, 2001, 22(2): 26-31] |
LIU C H, CHIU C H, WANG S W, et al. Dietary administration of the probiotic, Bacillus subtilis E20, enhances the growth, innate immune responses, and disease resistance of the grouper, Epinephelus coioides. Fish and Shellfish Immunology, 2012, 33(4): 699-706 DOI:10.1016/j.fsi.2012.06.012 |
LUIS-VILLASEÑOR I E, MACÍAS-RODRÍGUEZ M E, GÓMEZ-GIL B, et al. Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei. Aquaculture, 2011, 321(1/2): 136-144 |
LYNCH J P, ZHANEL G G, CLARK N M. Infections due to Acinetobacter baumannii in the ICU: Treatment options. Seminars in Respiratory and Critical Care Medicine, 2017, 38(3): 311-325 DOI:10.1055/s-0037-1599225 |
MERRIFIELD D L, DIMITROGLOU A, FOEY A, et al. The current status and future focus of probiotic and prebiotic applications for salmonids. Aquaculture, 2010, 302(1/2): 1-18 |
REDDY M R K, MASTAN S A. Emerging Acinetobacter schindleri in red eye infection of Pangasius sutchi. African Journal of Biotechnology, 2013, 12(50): 6992-6996 |
SKJERMO J, BAKKE I, DAHLE S W, et al. Probiotic strains introduced through live feed and rearing water have low colonizing success in developing Atlantic cod larvae. Aquaculture, 2015, 438: 17-23 DOI:10.1016/j.aquaculture.2014.12.027 |
SONG W, DING L, LIU M. Improving biohydrogen production through dark fermentation of steam-heated acid pretreated Alternanthera philoxeroides by mutant Enterobacter aerogenes ZJU1. Science of the Total Environment, 2020, 716: 134695 DOI:10.1016/j.scitotenv.2019.134695 |
WANG X, WU Y F, YAO X H, et al. Effect of probiotics on water quality and bacterial community in shrimp pools at later stage of cultivation. Acta Agriculturae Zhejiangensis, 2014, 26(1): 40-47 [王新, 吴逸飞, 姚晓红, 等. 微生态制剂对养殖后期虾池水质及细菌群落的影响. 浙江农业学报, 2014, 26(1): 40-47 DOI:10.3969/j.issn.1004-1524.2014.01.08] |
WONG D, NIELSEN T B, BONOMO R A, et al. Clinical and pathophysiological overview of Acinetobacter infections: A century of challenges. Clinical Microbiology Reviews, 2017, 30(1): 409-447 DOI:10.1128/CMR.00058-16 |
XU F L, WU P, REN Q X. The clinical manifestation and drug sensitive of Enterobacter aerogenes in lower respiratory tract infection. Medical Laboratory Science and Clinics, 2007, 18(3): 52-54 [徐风亮, 吴鹏, 任清霞. 产气肠杆菌下呼吸道感染的临床和耐药检测分析. 医学检验与临床, 2007, 18(3): 52-54 DOI:10.3969/j.issn.1673-5013.2007.03.021] |
XU Q Y, WANG J G, WANG L S, et al. Effect of Bacillus megaterium to plant protein meal on digestive enzyme activity and intestinal morphology of juvenile hybrid sturgeon. Journal of Northeast Agricultural University, 2017, 48(5): 50-57 [徐奇友, 王金革, 王连生, 等. 巨大芽孢杆菌对杂交鲟消化酶活性和肠道形态影响. 东北农业大学学报, 2017, 48(5): 50-57 DOI:10.3969/j.issn.1005-9369.2017.05.007] |
XU Z Y, WANG X L, YAN Q J, et al. Optimization of fermentation conditions on lactic acid production from sucrose by Enterobacter aerogenes. China Brewing, 2011, 1: 78-81 [徐忠义, 王新磊, 闫巧娟, 等. 产气肠杆菌发酵蔗糖产乳酸条件的优化. 中国酿造, 2011, 1: 78-81] |
ZHANG C M, JIA N, HU D, et al. Screening and application of compound bacillus for purifying freshwater aquaculture sediment. Chinese Journal of Environmental Engineering, 2017, 11(2): 1281-1286 [张翠绵, 贾楠, 胡栋, 等. 淡水养殖底泥净化复合芽孢杆菌的筛选与应用. 环境工程学报, 2017, 11(2): 1281-1286] |
ZHANG L C, LI Y M, YUAN Y S, et al. Research on the screening and characteristics of nitrosation denitrifying dephosphorization of five strains of phosphate accumulating organisms. Industrial Water Treatment, 2012, 32(4): 33-35 [张立成, 李艳美, 袁雅姝, 等. 5株聚磷菌的筛选与亚硝化反硝化除磷特性研究. 工业水处理, 2012, 32(4): 33-35 DOI:10.3969/j.issn.1005-829X.2012.04.009] |
ZHANG R, WANG G J. Advance of control Cyanobacteria bloom with Bacillus in aquaculture. Chinese Agricultural Science Bulletin, 2014, 30(29): 27-31 [张睿, 王广军. 芽孢杆菌防控水产养殖中蓝藻水华的研究进展. 中国农学通报, 2014, 30(29): 27-31 DOI:10.11924/j.issn.1000-6850.2014-1085] |



