2. 江苏海洋大学 江苏省海洋生物资源与环境 重点实验室 江苏 连云港 222005;
3. 江苏省海洋生物产业技术协同创新中心 江苏 连云港 222005;
4. 江苏省 农业种质资源保护与利用平台 江苏 南京 210014;
5. 连云港市海洋与渔业发展促进中心 江苏 连云港 222005
2. Jiangsu Ocean University, Key Laboratory of Marine Biological Resources and Environment of Jiangsu Province, Lianyungang, Jiangsu 222005, China;
3. Jiangsu Marine Biological Industry Technology Collaborative Innovation Center, Lianyungang, Jiangsu 222005, China;
4. Jiangsu Provincial Platform for Conservation and Utilization of Agricultural Germplasm, Nanjing, Jiangsu 210014, China;
5. Marine and Fishery Development Promotion Center, Lianyungang, Jiangsu 222005, China
在自然界中,大多数生物生活在昼夜交替变化的动态环境中。为识别、组织和响应感官信号,通过光照的感知对环境变化做出反应并进行相应的调整,生物进化出感光器官和生物钟机制(Peirson et al, 2009)。甲壳动物大多数具有复合眼,眼柄内的X–器官–窦腺复合体(X-organ-sinus gland, XO-SG)是重要的神经内分泌器官,其分泌的性腺抑制激素(gonad-inhibiting hormones, GIH)、蜕皮抑制激素(molt-inhibiting hormone, MIH)、大鄂器抑制激素(mandibularorgan-inhibiting hormone, MOIH)和血清素(5-hydroxy tryptamine, 5-HT)等肽类激素和神经递质在生理调控和卵巢发育过程中起关键作用(Wei et al, 2021; Zmora et al, 2009; Nagaraju et al, 2008)。眼柄组织是甲壳动物的感光器官,光线对其神经分泌细胞的正常分泌活动有调控作用(Vargas et al, 2010; 韩志斌, 2020),因此,一些甲壳动物在不同光照条件下的存活、生长、代谢和繁殖具有明显的差异性。王馨等(2014)研究发现,光照强度对三疣梭子蟹(Portunus trituberculatus)呼吸代谢的影响,在1500 lx光照强度下,三疣梭子蟹机体代谢水平较高,有利于其存活和生长。朱志煌等(2020)研究发现,正常光照组(12L︰12D)的红条鞭腕虾(Lysmata vittata)亲虾抱卵率为(95.8±3.6)%,而全暗(黑)组的抱卵率为0,表明适宜的光照条件能够促进红条鞭腕虾亲虾的抱卵行为。
脊尾白虾(Exopalaemon carinicauda)是一种近岸常见的海水经济虾类,近些年由于过度捕捞和环境污染,其种质资源相对减少,人工育苗技术也尚未完全成熟,开展脊尾白虾繁殖生物学研究以完善人工育苗技术成为一项重要任务(李健等, 2017)。性腺发育直接影响甲壳类的繁殖性能,是苗种培育的先决条件。目前一般通过升温和摘除眼柄(eyestalk ablation, ESA)对亲虾进行催熟,虽然升温催熟效果明显,但是应激反应相对较强,易造成亲虾死亡,ESA通常会导致受精卵质量降低,孵化率下降等情况(黄智伟等, 2019; 杨其彬等, 2016; 黄东科等, 2017)。目前,关于脊尾白虾的研究主要涉及生理生化(何先林等, 2021; 冯艳艳等, 2017)和基因克隆(Wu et al, 2021; 孙金秋等, 2020),而有关光照对其性腺发育的影响鲜有报道。光照周期(photoperiod)是调控生物节律的主要环境因子,可以尝试通过控制光照时长来调控虾类内分泌系统,达到一定的催熟效果(Imsland et al, 2018; Hou et al, 2019; 徐鹏翔等, 2012)。本研究以脊尾白虾为对象,通过控制不同的光照周期,探究脊尾白虾生长、性腺发育以及血淋巴生化成分状况,以期为脊尾白虾亲虾催熟和工厂化养殖提供帮助。
1 材料与方法 1.1 实验材料实验在江苏省海洋生物技术重点实验室进行,脊尾白虾取自本实验室水产养殖室,挑选活力良好、附肢完整、卵巢未发育的雌虾,平均体质量为(0.71±0.05) g,平均体长为(3.62±0.28) cm。暂养72 h后用于实验,暂养期间水温为23~25℃,盐度为22~24,pH为7.8~ 8.1,水体溶解氧 > 5 mg/L。每日投喂2次(08:00和17:00)配合饲料(海大饲料有限公司),投饵量为脊尾白虾体质量的3%。实验光源为LED日光灯(5 W),黑色遮光布购自市场,经清洗消毒后备用。
1.2 实验设计本实验设置5个光周期组,分别为L(全光照)、16L︰8D、12L︰12D、8L︰16D、D (全黑暗),其中L表示光照时长,D表示黑暗时长,每个处理组均设置3个平行,光照强度为1000 lx,通过透气黑色遮光布控制光照时长。水产养殖箱规格为55 cm×40 cm×30 cm,每个养殖箱放30尾脊尾白虾,实验周期为30 d。
1.3 养殖实验日常管理实验期间水温保持在23~25℃,盐度为22~24,pH 7.8~8.1,24 h连续曝气,使水体溶解氧 > 5 mg/L。每日投喂2次配合饲料(08:00和17:00),投饵量为脊尾白虾体质量的3%,投喂前先用塑料虹吸管吸除粪便,如有死虾,及时捞出。投喂后1.5 h清除残饵,根据脊尾白虾的摄食情况对投饵量进行适当增减,每日换水20%。养殖室内LED日光灯全天候照明,全光照组不设置遮光布,24 h接受光照;16L︰8D组在08:00使用黑色透气遮光布盖住,16:00揭开;12L︰12D组在08:00使用遮光布盖住,20:00揭开;8L︰16D组在08:00揭开遮光布,16:00盖住;D组24 h用遮光布盖住。
1.4 指标测定及计算方法实验期间,根据每日蜕掉的头胸甲数目记录蜕壳次数。每10 d各组随机选取10尾虾,测量卵巢长度(卵巢前缘至卵巢后缘)和体长。实验结束后,统计各组存活尾数和卵巢发育成熟尾数,每组随机选取10尾虾,取出卵巢,称量体质量和卵巢质量。使用微量进样器刺穿脊尾白虾围心腔抽取血淋巴,抗凝剂(柠檬酸钠50 mmol/L,EDTA-2NA 10 mmol/L,pH 7.3)和血淋巴体积比为1︰1,混合后经4℃,3500 r/min离心10 min去除血细胞沉淀,吸取上清液保存于4℃,24 h内进行测定。
1.4.1 生长指标的测定根据下列公式计算存活率(survival rate, SR)、特定生长率(specific growth rate, SGR)和蜕壳率(molting frequency rate, MF)。
| $ {\text{SR}}({\text{% }}) = \frac{M}{N} \times 100 $ |
| $ {\text{SGR}} (\% ) = \frac{{(\ln {W_t} - \ln {W_0})}}{t} \times 100 $ |
| $ {\text{MF}}(\% ) = \frac{{{M_m}}}{{{N_s} \times t}} \times 100 $ |
式中,M是实验结束时各组脊尾白虾的存活数量(尾),N为实验开始时各组投放的脊尾白虾数量(尾);Wt是实验结束时脊尾白虾的平均体质量(g),W0为实验开始时脊尾白虾的平均体质量(g);Mm是实验期间蜕壳次数(次),Ns是蜕壳虾数目(尾);t是实验周期(d)。
1.4.2 性腺发育指标的测定根据下列公式计算性腺指数(gonadosomatic indexes, GSI)、卵巢成熟率、卵巢相对长度。
| $ {\text{GSI}}(\% ) = \frac{{{W_L}}}{W} \times 100 $ |
| $ 卵巢成熟率(\%)=\frac{{N}_{f}}{N}\times 100 $ |
| $ 卵巢相对长度(\%)=\frac{{L}_{t}}{L}\times 100 $ |
式中,WL是卵巢质量(g),W是脊尾白虾体质量(g);Nf是实验结束时卵巢发育成熟尾数(尾),N是实验开始时投放的尾数(尾);Lt是卵巢长度(cm),L是脊尾白虾体长(cm)。
1.4.3 血淋巴生化成分指标的测定测定血淋巴中蛋白质、胆固醇、甘油三脂、葡萄糖浓度均使用南京建成生物工程研究所试剂盒。蛋白质浓度用考马斯亮蓝法测定,胆固醇浓度用COD-PAP法测定,甘油三脂浓度用GPO-PAP酶法测定,葡萄糖浓度用葡萄糖氧化酶法测定,吸光度值均用酶标仪测定,所有操作按照说明书的步骤进行。
1.5 数据分析实验数据采用SPSS 23.0软件进行单因素方差分析(one-way ANOVA),用Student-Newman-Keul´s检验法分析组间差异显著性,P < 0.05表示差异显著,所有数据用平均值±标准误(Mean±SE)表示,采用Origin 2017绘制图表。
2 结果与分析 2.1 不同光照周期对脊尾白虾存活、生长、蜕皮的影响不同光照周期对脊尾白虾存活、生长、蜕皮的影响见表 1。由表 1可知,实验结束时,D组存活率最高,为(86.67±5.77)%;8L︰16D组存活率为(80.00± 3.33)%,与D组差异不显著(P > 0.05);L组存活率最低,为(55.56±6.94)%,显著低于D组、12L︰12D组和8L︰16D组(P < 0.05)。总体上看,随着光照时间的增加,存活率显著下降(P < 0.05)。
|
|
表 1 不同光照周期下脊尾白虾的生长指标 Tab.1 Growth indexes of E. carinicauda under different photoperiods |
在不同光照周期条件下,脊尾白虾的生长情况具有一定差异。12L︰12D组特定生长率最高,为(2.51± 0.15)%/d,与8L︰16D组差异不显著(P > 0.05);L组特定生长率最低,为(2.03±0.25)%/d,与12L︰12D组和8L︰16D组差异显著(P < 0.05)。
脊尾白虾蜕壳率随光照时间的延长,总体呈降低趋势。12L︰12D组、8L︰16D组和D组之间差异不显著(P > 0.05),但均显著高于16L︰8D组和L组(P < 0.05);其中8L︰16D组蜕壳率最高,为(6.96±0.50)次/(尾·d);L组蜕壳率最低,为(4.14±0.28)次/(尾·d)。
2.2 不同光照周期对脊尾白虾性腺发育的影响不同光照周期对脊尾白虾性腺指数的影响见图 1。从图 1可以看出,随着光照时间的缩短,脊尾白虾的性腺指数逐渐增大,在8L时达到最高值,为(2.37± 0.04)%,显著高于其他各组(P < 0.05),但在D组全黑暗的条件下,脊尾白虾的性腺指数大幅下降,为(1.87± 0.12)%;L组性腺指数[(1.60±0.03)%]显著低于其他各组(P < 0.05)。
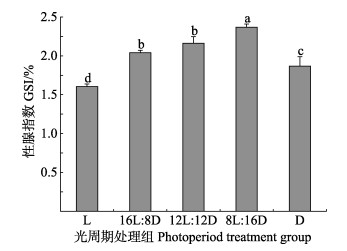
|
图 1 不同光照周期下脊尾白虾的性腺指数 Fig.1 Gonadosomatic indexes of E. carinicauda under different photoperiods 不同上标字母表示组间差异显著(P < 0.05),下同。 Different letters indicate significant difference between groups (P < 0.05), the same as below. |
不同光照周期对脊尾白虾卵巢成熟率的影响见图 2。由图 2可知,12L︰12D组卵巢成熟率最高,为(43.79±3.84)%,显著高于D组(30.71±2.35)% (P < 0.05);16L︰8D、12L︰12D、8L︰16D 3组之间卵巢成熟率差异不显著(P > 0.05)。
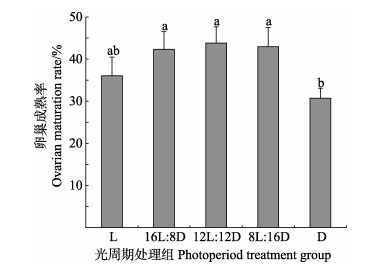
|
图 2 不同光照周期下脊尾白虾的卵巢成熟率 Fig.2 Ovarian maturation rate of E. carinicauda under different photoperiods |
不同光照周期对脊尾白虾卵巢相对长度的影响见图 3。由图 3可知,实验第10天,8L︰16D组卵巢相对长度最大,为(5.16±0.24)%;D组卵巢相对长度最小,为(4.43±0.18)%。8L︰16D和16L︰8D组卵巢相对长度显著大于L、12L︰12D和D组(P < 0.05),但8L︰16D和16L︰8D组之间差异不显著(P > 0.05)。实验第20天,L组卵巢相对长度[(6.14±0.10)%]显著低于各组(P < 0.05),随着光照时间的缩短,卵巢相对长度呈上升趋势,在8L时达到最大值,为(7.21±0.11)%,显著大于其他组(P < 0.05)。实验第30天,12L︰12D组和8L︰16D组卵巢相对长度仍然保持较高水平,其中,8L︰16D组卵巢相对长度[(10.57±0.09)%]显著高于其他各组(P < 0.05);16L︰8D和D组之间无显著差异(P > 0.05);L组卵巢相对长度[(7.26±0.12)%]显著低于其他各组(P < 0.05)。
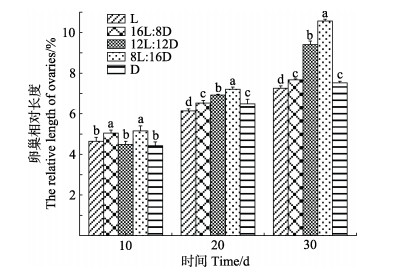
|
图 3 不同光照周期下脊尾白虾的卵巢相对长度 Fig.3 Relative length of ovaries of E. carinicauda under different photoperiod |
不同光照周期对脊尾白虾血淋巴蛋白质和胆固醇浓度的影响见图 4。由图 4A和4B可知,随着光照时间的延长,血淋巴蛋白质和胆固醇含量呈先升高后降低的趋势,在12L时达到最高值,分别为(129.98± 4.68) mg/L和(83.91±5.06) mg/dL,显著高于L、16L︰8D和D组(P < 0.05),与8L︰16D组差异不显著(P > 0.05)。
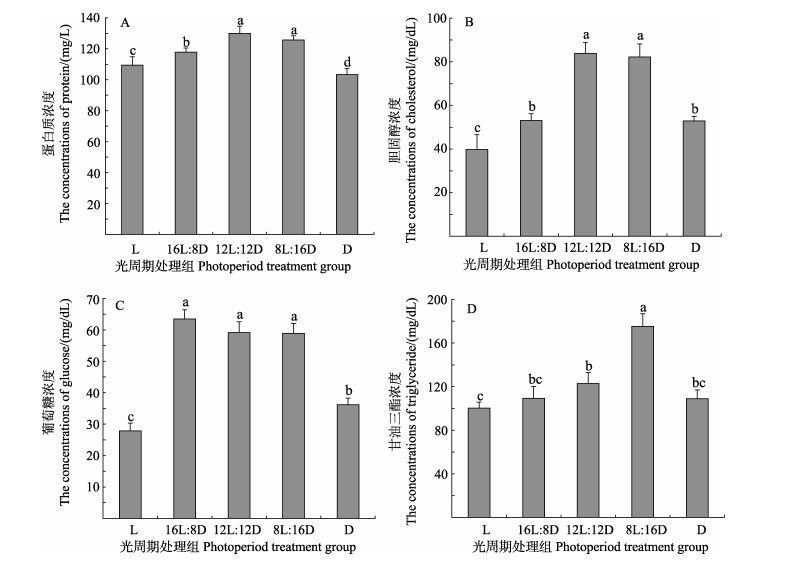
|
图 4 不同光照周期下脊尾白虾的血淋巴生化成分 Fig.4 Biochemical components of haemolymph of E. carinicauda under different photoperiod |
不同光照周期对脊尾白虾血淋巴葡萄糖浓度的影响见图 4C。由图 4C可知,血淋巴葡萄糖浓度随光照时间的延长呈先上升后下降的趋势,16L︰8D组达到最高值,为(63.50±2.91) mg/dL,与12L︰12D和8L︰16D组之间差异不显著(P > 0.05)。L组全光照条件下,葡萄糖含量骤降为(27.87±2.43) mg/dL,显著低于其他各组(P < 0.05)。
不同光照周期对脊尾白虾血淋巴甘油三酯浓度的影响见图 4D。由图 4D可知,血淋巴甘油三酯浓度随光照时间的延长呈先上升后下降的趋势,8L︰16D组甘油三酯浓度为(175.32±11.58) mg/dL,显著高于其他组(P < 0.05),L组全光照条件下甘油三酯浓度下降到最低值[(100.35±5.41) mg/dL]。
3 讨论 3.1 不同光照周期对甲壳动物存活和生长的影响光周期现象最早在植物中发现,植物的开花、结果和其他生理活动均受光周期影响(刘莉等, 2004)。随着光照调控在水产养殖中的应用,越来越多的学者认为,光照周期对于水生动物来说是不可忽略的环境因素。王想等(2020)研究发现,日本囊对虾(Marsupenaeus japonicas)工厂化养殖的最适宜生长环境为全黑暗状态。本研究也表明,全黑暗状态下的脊尾白虾存活率最高。吴志新等(2020)研究发现,在全黑暗条件下,红鳌螯虾(Cherax quadricarinatus)亲虾的存活率最低,虾苗的生长速度最慢。由此可以看出,光照周期对甲壳动物存活的影响因种而异,不同的物种其适宜的光照周期也会有所差异。Matsuda等(2011)研究表明,14L︰10D光周期能促进日本龙虾(Panulirus japonicus)幼体的变态发育,缩短光照时间会导致幼体变态发育滞后,说明适宜的接受光照有利于日本龙虾幼体的生长。本研究结果显示,12L︰12D组的脊尾白虾特定生长率最高,8L︰16D组蜕壳率最高,与上述研究结果并不完全一致。这可能与脊尾白虾长时间的遗传进化有关,野生脊尾白虾的生存环境为自然海区,海面光照周期接近12L︰12D,而光照强度会随着水深的增加逐渐变弱,某些生存环境的光照时长可能不足12 L,因此,12L︰12D和8L︰16D更有利于脊尾白虾的生长。甲壳动物的外部形态、激素水平、代谢途径等在不同的生长发育阶段通常具有差异性,因此,除物种外,生长阶段也可能是影响甲壳动物适宜光照周期的重要因素。
3.2 不同光照周期对甲壳动物性腺发育的影响甲壳动物性腺发育的调控需要神经肽、激素和神经递质等多种调节因子的参与。在生物进化的过程中,甲壳动物形成了较为完善的生殖调控系统,相关激素水平会随外界环境作出相应改变,保证甲壳动物在最适机体状态下进行生殖活动(王晓伟等, 2013)。眼柄组织是甲壳动物感受和传导外界环境变化信息的主要器官,尤其是对于光照信号的感知和传导(Nelson-Mora et al, 2013)。甲壳动物眼柄中的XO-SG在结构和功能上类似脊椎动物的下丘脑-神经垂体系统,通过合成与分泌多种肽类内分泌激素和神经递质(GIH、MIH、MOIH和5-HT)参与生理调节,对卵巢发育产生影响。罗嘉俊等(2020)研究发现,光周期为14L︰10D时,波纹龙虾(Panulirus homarus)眼柄中GIH的表达量显著降低,促进卵巢的发育。Matsuda等(2002)研究表明,光周期是影响日本龙虾性腺发育和产卵的重要因素,在温度为25℃,光周期为14L︰10D的条件下卵巢发育速度最快,抱卵率也最高。徐加元等(2008)研究表明,克氏原螯虾(Procambarus clarkii)性腺发育的最适光周期为16L︰8D,适当延长光照时间能提高其性腺发育速度。本研究结果显示,光照周期为8L︰16D时,脊尾白虾的性腺指数显著高于其他组;12L︰12D组脊尾白虾的卵巢成熟率最高,但和8L︰16D组无显著差异;光照周期为8L︰16D时,脊尾白虾的卵巢相对长度显著高于其他组,表明8L︰16D是适合脊尾白虾性腺发育的光照周期,适当缩短光照时间能促进脊尾白虾的性腺发育。本研究结果与前人研究结果有所差异,可能因为不同种甲壳动物对光线的敏感程度和反馈机制不同所致,具体原因还需要进一步探索。
甲壳动物性腺发育需要积累大量的营养物质(董燕妮等, 2013; 孙丽慧等, 2019; 赵旺等, 2019)。Palacios等(2000)研究指出,凡纳滨对虾(Litopenaeus vannamei)卵巢积累营养物质达到一定水平才能发育成熟。在性腺发育过程中,储存在肝胰腺中的营养物质通过血淋巴输送转移到卵巢中(Arcos et al, 2003)。蛋白质、葡萄糖、甘油三酯和胆固醇是甲壳动物卵巢发育和能量代谢不可缺少的营养物质,血淋巴中的营养物质浓度可以在一定程度上反映卵巢发育速度和质量。本研究结果显示,8L︰16D和12L︰12D组脊尾白虾血淋巴蛋白质和胆固醇浓度较高;8L︰16D组甘油三酯浓度显著高于其他组,表明8L︰16D光照周期能促进血淋巴的营养运输,加快卵巢发育。16L︰8D组葡萄糖浓度最高,但卵巢发育程度相对较差,可能因为长时间光照的胁迫对其营养分配和能量代谢产生了一定的影响。
综上所述,光照周期显著影响脊尾白虾的存活、生长以及性腺发育。生产上采用适宜的光照周期来综合调控脊尾白虾的性腺发育不失为一种经济而有效的方法,8L︰16D是脊尾白虾亲虾促熟和工厂化养殖较为适宜的光照周期。
ARCOS G F, IBARRA A M, VAZQUEZ-BOUCARD C, et al. Haemolymph metabolic variables in relation to eyestalk ablation and gonad development of Pacific white shrimp Litopenaeus vannamei Boone. Aquaculture Research, 2003, 34(9): 749-755 DOI:10.1046/j.1365-2109.2003.00878.x |
DONG Y N, WU C, LIN Q W, et al. Variation in biochemical components of ovary during the ovarian maturation of Marsupenaeus japonicus under different conditions. Journal of Xiamen University (Natural Science), 2013, 52(3): 421-426 [董燕妮, 吴超, 林琼武, 等. 不同处理条件对日本囊对虾亲虾卵巢发育及几种生化组分浓度的影响. 厦门大学学报(自然科学版), 2013, 52(3): 421-426] |
FENG Y Y, LI J, LI J T, et al. Effects of florfenicol on the immune and antioxidant activities of Exopalaemon carinicauda. Progress in Fishery Sciences, 2017, 38(5): 140-147 [冯艳艳, 李健, 李吉涛, 等. 氟苯尼考对脊尾白虾(Exopalaemon carinicauda)免疫和抗氧化功能的影响. 渔业科学进展, 2017, 38(5): 140-147] |
HAN Z B. Effect of photoperiod on melatonin circadian rhythm and regulation in the eyestalk of Chinese mitten crab Eriocheir sinensis. Master´s Thesis of Shenyang Agricultural University, 2020, 20–28 [韩志斌. 光周期对中华绒螯蟹褪黑激素昼夜节律的影响及眼柄的调控作用研究. 沈阳农业大学硕士研究生学位论文, 2020, 20–28]
|
HE X L, LIU M M, DONG Z G, et al. Effects of different diets on culture performance, physiological metabolism and biochemical composition of ridgetail white prawns, Exopalaemon carinicauda. Journal of Biology, 2021, 38(5): 66-71 [何先林, 柳梅梅, 董志国, 等. 不同饵料对脊尾白虾养殖性能、生理代谢和生化组成的影响. 生物学杂志, 2021, 38(5): 66-71 DOI:10.3969/j.issn.2095-1736.2021.05.066] |
HOU Z S, WEN H S, LI J F, et al. Effects of photoperiod and light Spectrum on growth performance, digestive enzymes, hepatic biochemistry and peripheral hormones in spotted sea bass (Lateolabrax maculatus). Aquaculture, 2019, 507: 419-427 DOI:10.1016/j.aquaculture.2019.04.029 |
HUANG D K, LIANG H F, ZHANG Z, et al. The effect of temperature on the survival, foodintake, molting and growth of Panulirus homarus. Acta Ecologica Sinica, 2017, 37(18): 5973-5980 [黄东科, 梁华芳, 张志, 等. 温度对波纹龙虾存活、摄食、蜕壳和生长的影响. 生态学报, 2017, 37(18): 5973-5980] |
HUANG Z W, SHI Y H, WANG A M, et al. Effects of eyestalk ablation on growth, gonadal development and body color of Cherax quadricarinatus. Marine Fisheries, 2019, 41(3): 322-328 [黄智伟, 石耀华, 王爱民, 等. 眼柄摘除对红螯光壳螯虾生长、性腺发育及体色的影响. 海洋渔业, 2019, 41(3): 322-328 DOI:10.3969/j.issn.1004-2490.2019.03.007] |
IMSLAND A K, JONASSEN T M, HANGSTAD T A, et al. The effect of continuous light and compressed photoperiods on growth and maturation in lumpfish Cyclopterus lumpus. Aquaculture, 2018, 485: 166-172 DOI:10.1016/j.aquaculture.2017.11.053 |
LI J, LIU P, ZHAO F Z. Ridgetail white prawn. Qingdao: China Ocean University Press, 2017 [李健, 刘萍, 赵法箴. 脊尾白虾. 青岛: 中国海洋大学出版社, 2017]
|
LIU L, ZHU P F. Relationship between photoperiod and plant floral induction. Liaoning Agricultural Sciences, 2004(3): 26-27 [刘莉, 祝朋芳. 光周期与植物成花诱导. 辽宁农业科学, 2004(3): 26-27 DOI:10.3969/j.issn.1002-1728.2004.03.010] |
LUO J J, ZHUO H B, CHEN J T, et al. Cloning, expression and photoperiodic response of gonad-inhibiting hormone (GIH) gene in scalloped spiny lobster Panulirus homarus. Journal of Dalian Ocean University, 2021, 36(5): 727-735 [罗嘉俊, 卓宏标, 陈俊涛, 等. 波纹龙虾GIH基因克隆、表达及其对光周期的响应. 大连海洋大学学报, 2021, 36(5): 727-735] |
MATSUDA H, ABE F, TANAKA S. Effect of photoperiod on metamorphosis from phyllosoma larvae to puerulus postlarvae in the Japanese spiny lobster Panulirus japonicus. Aquaculture, 2011, 326–329: 136-140 |
MATSUDA H, TAKENOUCHI T, YAMAKAWA T. Effects of photoperiod and temperature on ovarian development and spawning of the Japanese spiny lobster Panulirus japonicus. Aquaculture, 2002, 205(3/4): 385-398 |
NAGARAJU G P C, BORST D W. Methyl farnesoate couples environmental changes to testicular development in the crab Carcinus maenas. Journal of Experimental Biology, 2008, 211(17): 2773-2778 DOI:10.1242/jeb.019133 |
NELSON-MORA J, PRIETOSAGREDO J, LOREDORANJEL R, et al. Putative pacemakers in the eyestalk and brain of the crayfish Procambarus clarkii show circadian oscillations in levels of mRNA for crustacean hyperglycemic hormone. PLoS One, 2013, 8(12): e83937 DOI:10.1371/journal.pone.0083937 |
PALACIOS E, IBARRA A M, RACOTTA I S. Tissue biochemical composition in relation to multiple spawning in wild and pond-reared Penaeus vannamei broodstock. Aquaculture, 2000, 185(3/4): 353-371 |
PEIRSON S N, HALFORD S, FOSTER R G. The evolution of irradiance detection: Melanopsin and the non-visual opsins. Philosophical Transactions of the Royal Society B, 2009, 364(1531): 2849-2865 DOI:10.1098/rstb.2009.0050 |
SUN J Q, XU W Y, MA H K, et al. Cloning and expression analysis of serine hydroxyl methyltransferase (SHMT) genes from Exopalamon carinicauda. Progress in Fishery Sciences, 2020, 41(1): 127-134 [孙金秋, 徐莞媛, 马杭柯, 等. 脊尾白虾丝氨酸羟甲基转移酶基因的克隆及其表达特征分析. 渔业科学进展, 2020, 41(1): 127-134] |
SUN L H, LIN F, HUANG A X, et al. On nutritional trends of muscle and hepatopancreas in the molting cycle of male Scylla paramamosain. Marine Fisheries, 2019, 41(6): 694-703 [孙丽慧, 林锋, 黄爱霞, 等. 拟穴青蟹雄蟹蜕壳周期肌肉与肝胰腺营养变化趋势. 海洋渔业, 2019, 41(6): 694-703 DOI:10.3969/j.issn.1004-2490.2019.06.006] |
VARGAS M A, GEISH M A, MACIEL F E, et al. Influence of the dark/light rhythm on the effects of UV radiation in the eyestalk of the crab Neohelice granulata. Comparative Biochemistry and Physiology, Part C Comparative Pharmacology, 2010, 151(3): 343-350 |
WANG X W, ZHANG Z P, WANG Y L, et al. Research progress on the regulation mechanism of ovarian development in shrimps and crabs. Biotechnology Bulletin, 2013(7): 29-35 [王晓伟, 张子平, 王艺磊, 等. 虾蟹类卵巢发育调节机制研究进展. 生物技术通报, 2013(7): 29-35] |
WANG X, REN X Y, SHENG X Z, et al. Effects of different photoperiods on growth, molting and glucose metabolism of Marsupenaeus japonicus. Progress in Fishery Sciences, 2020, 41(6): 66-73 [王想, 任宪云, 绳秀珍, 等. 不同光照周期对日本囊对虾生长、蜕皮和糖代谢的影响. 渔业科学进展, 2020, 41(6): 66-73] |
WANG X, WANG F, LU Y L, et al. Effects of light intensity on the respiratory metabolism of swimming crab (Portunus trituberculatus). Journal of Fisheries of China, 2014, 38(2): 237-243 [王馨, 王芳, 路允良, 等. 光照强度对三疣梭子蟹呼吸代谢的影响. 水产学报, 2014, 38(2): 237-243] |
WEI J, TIAN L, WANG Y K, et al. Effects of salinity, photoperiod, and light spectrum on larval survival, growth, and related enzyme activities in the giant freshwater prawn, Macrobrachium rosenbergii. Aquaculture, 2021, 530: 753794 |
WU Z X, CHEN X X, LIU X L, et al. Effects of different photoperiods on reproduction and growth of Cherax quadricarinatus. Freshwater Fisheries, 2000, 30(3): 4-5 [吴志新, 陈孝煊, 刘小玲, 等. 不同光周期对红螯螯虾繁殖及生长的影响. 淡水渔业, 2000, 30(3): 4-5 DOI:10.3969/j.issn.1000-6907.2000.03.002] |
WU Z X, LIU Y J, ZHENG J Q, et al. Genomic structure, expression and functional characterization of arginine kinase (EcAK) from Exopalaemon carinicauda. Fish and Shellfish Immunology, 2021, 109: 82-86 DOI:10.1016/j.fsi.2020.12.009 |
XU J Y, YUE C F, DAI Y, et al. Effects of water temperature, photoperiod and diet on survival rate and ovarian development of the crawfish, Procambarus clarkill. Journal of Hunazhong Normal University (Natural Science), 2008, 42(1): 97-101 [徐加元, 岳彩锋, 戴颖, 等. 水温、光周期和饲料对克氏原螯虾雌虾成活和性腺发育的影响. 华中师范大学学报(自然科学版), 2008, 42(1): 97-101 DOI:10.3321/j.issn:1000-1190.2008.01.022] |
XU P X, LI Y C, ZHU G P, et al. Observation on behaviours of Antarctic krill (Euphausia superba) in lighting condition. Journal of Fisheries of China, 2012, 36(2): 300-305 [徐鹏翔, 李莹春, 朱国平, 等. 光照条件下南极磷虾的行为观察. 水产学报, 2012, 36(2): 300-305] |
YANG Q B, QIU L H, HUANG J H, et al. Effects of unilateral eyestalk ablation on ovary development and spawning of cultured tiger shrimp Penaeus monodon with different body weight. Fisheries Science, 2016, 35(5): 516-521 [杨其彬, 邱丽华, 黄建华, 等. 切除单侧眼柄对不同体质量养殖斑节对虾卵巢发育及产卵的影响. 水产科学, 2016, 35(5): 516-521] |
ZHAO W, YANG Q B, CHEN X, et al. A review of research on the biological properties and reproductive biology of some mantis shrimps. Marine Sciences, 2019, 43(4): 105-114 [赵旺, 杨其彬, 陈旭, 等. 几种虾蛄生物学特性和繁殖生物学研究进展. 海洋科学, 2019, 43(4): 105-114] |
ZHU Z H, WU J S, ZHOU C, et al. Effects of light on the reproductive performance of Lysmata vittata and influences of diets on the growth and development of its larvae. Journal of Fishery Sciences of China, 2020, 27(2): 260-267 [朱志煌, 吴建绍, 周宸, 等. 光照对红条鞭腕虾繁殖性能及饵料对其幼体生长发育的影响. 中国水产科学, 2020, 27(2): 260-267] |
ZMORA N, SAGI A, ZOHAR Y, et al. Molt-inhibiting hormone stimulates vitellogenesis at advanced ovarian developmental stages in the female blue crab, Callinectes sapidus 2: Novel specific binding sites in hepatopancreas and cAMP as a second messenger. Saline Systems, 2009, 5(1): 6 DOI:10.1186/1746-1448-5-6 |



