2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China
著名的“基林曲线(Keeling curve)”连续监测结果显示,从1958年左右开始,大气CO2浓度在长达数十年的时间里呈逐年快速攀升趋势(https://scripps.ucsd.edu/programs/keelingcurve/),目前已经长时间稳定在0.041%(体积百分比)以上。由此引发的全球气候变化成为全球关注的热点问题,也成为21世纪人类面临的重要环境问题之一。作为负责任的大国,从1992年的《联合国气候变化框架公约》,到1997年的《京都议定书》,再到2015年的《巴黎协定》,我国一直是全球应对气候变化的贡献者和参与者。2020年9月22日,习近平总书记在第七十五届联合国大会上提出中国“2030碳达峰,2060碳中和”的“双碳”宏伟目标,标志着我国气候变化应对工作进入了新的发展阶段。
降低大气CO2浓度的应对措施主要包括减排和固碳2种方法。对于CO2的固定和储存,又可通过2种途径来实现:工业手段和生物固碳。就目前的科技水平来说,利用工业手段封存CO2等温室气体,在技术层面并未很成熟,且成本高。而通过生物碳汇扩增,不仅技术成熟、成本低,而且兼具经济、生态、社会等多种效益,一举多得。
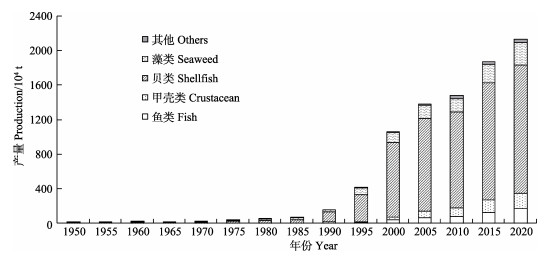
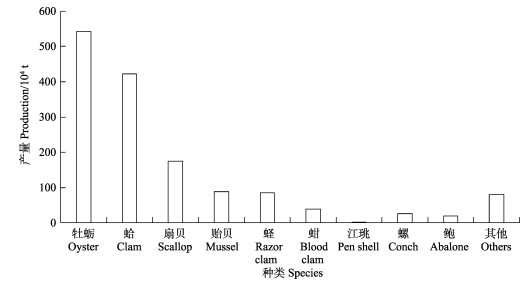
“渔业碳汇”是生物碳汇的一种,是指通过渔业生产活动促进水生生物吸收或使用水体中CO2等温室气体,并通过收获把这些已经转化为生物产品的碳移出水体或通过生物沉积作用将其沉降于水底的过程和机制(唐启升等, 2022)。从渔业角度来说,生物碳汇扩增对于中国的意义尤为重要。我国是世界渔业大国,也是世界海水养殖第一大国,海水养殖产量占世界海水养殖产量的50%以上。作为海洋渔业的重要组成部分,自1978年左右开始,我国的海水养殖业在理念、政策、科技等多个层面的坚强支撑下,依靠丰富的自然资源和低成本的劳动力资源等要素投入实现了养殖规模的快速扩大和养殖产量的迅猛增长(图 1)。2020年,海水养殖产量达到2 135.31万t,占海水产品产量的64.4%,产值达到3 836.20亿元(2021中国渔业统计年鉴)。基于养殖容量评估、养殖贝藻类生态服务功能、海水生态养殖模式等方面的研究基础(方建光等, 1996; Tang et al, 2011),2010年,中国工程院唐启升院士率先提出了“碳汇渔业”理念,在海洋渔业与气候变化之间搭建桥梁,并将海水养殖业的地位由传统产业提升到战略性新兴产业的高度。与其他国家相比,我国的海水养殖独具产量高、物种多样性丰富、营养层级多、不投饵率高等显著特点(唐启升等, 2016),从养殖结构看,贝类是主要养殖种类,约占总产量的70% (图 1),进一步对贝类的种类结构进行细分可发现,滤食性贝类产量约占贝类养殖总产量的95% (图 2, 2021中国渔业统计年鉴)。作为一种碳基生物,滤食性贝类及其所处的生态系统与碳的生物地球化学过程关系密切。因此,解析滤食性贝类养殖驱动的碳汇形成过程和机制,理清滤食性贝类养殖生态系统的碳汇逻辑,对于客观、科学地评价海水贝类养殖的碳汇效应及其对服务国家“双碳”战略目标的作用和贡献具有重要的理论和现实意义。
|
图 1 1950—2020年每5年我国海水养殖产量及种类组成情况 Fig.1 Production and species composition of mariculture in China every five years from 1950 to 2020 |
|
图 2 2020年我国海水养殖贝类种类结构及产量(数据来源:2021中国渔业统计年鉴) Fig.2 Species structure and production of mariculture shellfish in China in 2020 (Data source: Chinese fishery statistics yearbook 2021) |
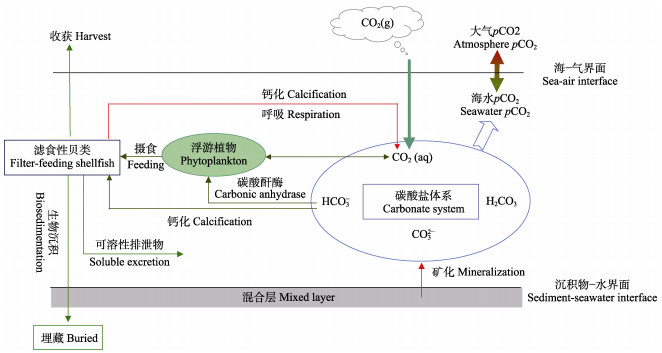
滤食性贝类是近海自然和养殖生态系统中重要的生态类群,通过摄食、钙化、呼吸、排粪等生理活动影响着碳的生物地球化学过程(图 3)。从碳的角度来说,贝类主要通过直接或间接2种途径使用海洋中的碳:一种是溶解无机碳(DIC)途径,通过吸收海水中的HCO3–形成主要成分为CaCO3的贝壳,广为熟知的方程式为:Ca2++2HCO3−=CaCO3+CO2+H2O,该过程从海水中吸收2 moL HCO3−,形成1 moL CaCO3,同时释放0.6~0.8 moL CO2 (Frankignoulle et al, 1994; Morris et al, 2019);另一种是颗粒有机碳(POC)途径,通过滤水摄取水体中的悬浮颗粒有机碳(包括浮游植物和颗粒有机碎屑等)促进贝类个体软组织的生长,同时,伴随着呼吸作用释放CO2,此外,通过排泄和排粪行为,排出可溶性排泄物和颗粒态生物沉积物(粪便和假粪),加快碳的垂直输运,并在沉积物–水界面的混合层发生再悬浮、矿化等生物地球化学过程,最终,部分颗粒有机碳实现了埋藏(Filgueira et al, 2019)。
|
图 3 滤食性贝类对碳元素关键生物地球化学过程的影响示意图 Fig.3 Schematic diagram of the impact of filter-feeding shellfish on key carbon biogeochemical processes |
在定量化研究层面,滤食性贝类驱动的不同形态碳的迁移转化能力是该领域重点关注的研究内容。近年来,国内外学者从贝类的收获行为移出碳能力、个体水平碳收支、生命周期评价、生物沉积颗粒有机碳、对海–气界面CO2交换的影响等多个角度开展了一系列的相关研究。研究表明,1999—2008年,通过收获养殖贝类,每年从我国近海移出的碳量为70~99万t (平均86万t),其中,67万t碳以贝壳的形式被移出海洋(张继红等, 2005; Tang et al, 2011)。随着对贝类介导碳循环过程的全面性认识的不断深入,学者们采用多种研究方法陆续开展了栉孔扇贝(Chlamys farreri)、长牡蛎(Crassostrea gigas)、菲律宾蛤仔(Ruditapes philippinarum)等多种经济贝类个体碳收支方面的研究。基于物质平衡方程C=F+U+R+G (C、F、U、R和G分别表示摄入碳、排粪碳、排泄碳、呼吸碳和生长碳)的结果显示,在约500 d的养殖周期中,每个栉孔扇贝通过摄食和钙化作用使用10 170 mg C,通过收获移出碳约占30% (贝壳固碳2070 mg和软体部固碳1005 mg),沉积粪便及代谢物约占40%左右(3985 mg C),呼吸钙化作用等释放的碳约占30% (唐启升等, 2013);在约360 d的养殖周期中,长牡蛎的排粪碳占总摄食碳的42%~48%,是碳支出比例最大的部分,通过呼吸作用产出的碳所代表的代谢碳占11%~22%,每个长牡蛎摄食水体中14 968 mg C,最终形成了3个碳埋藏出口:3600 mg C的贝壳固碳,430 mg C的软体部固碳和3322 mg C的生物沉积物固碳,被长牡蛎使用的碳中有49.1%进入了固碳渠道(任黎华, 2014);菲律宾蛤仔个体在一个养殖周期内(约730 d)使用了3 310.1 mg碳,其中约46.1%碳沉降至海底,约13.3%的碳通过收获移出(姜娓娓等, 2022)。Turolla等(2020)研究采用生命周期评价(LCA)方法评估了亚得里亚海北部Sacca di Goro泻湖菲律宾蛤仔养殖实践的环境友好性及碳汇能力,发现每收获1 t的蛤仔每年可固定CO2 444.55 kg。在生物沉积颗粒有机碳研究方面,聂梦晨等(2022)研究利用碳(δ13C)氮(δ15N)稳定同位素技术甄别了贝类养殖区沉积物中有机质的来源,发现贝类生物沉积、土壤有机质和海带是北方规模化贝类养殖海湾—桑沟湾沉积物有机质的主要来源,贡献率分别为67.52%、26.47%和5.97%,认为养殖贝藻类生物沉积对近海碳埋藏具有显著影响。在海–气界面CO2交换通量研究方面,蒋增杰等(2012)研究发现,规模化牡蛎养殖区海–气界面CO2交换通量范围为–53.78 ~ –21.93 mmol/(m2·d),表现为海水吸收大气CO2的趋势,且养殖区与非养殖区差异不显著;Zhang等(2022)研究采用涡度相关法对我国东南沿海亚热带河口缢蛏养殖池塘水–气界面CO2通量及环境因子开展涡度相关长期连续观测,基于2020年全年每半小时的通量观测数据分析表明,海水养殖塘水气界面表现为CO2的强汇(–227.7 g C/m2)。Bertolini等(2021)研究利用生理能量学模型对威尼斯泻湖内养殖菲律宾蛤仔的呼吸及钙化过程进行了参数化处理,并模拟研究了整个养殖周期内的CO2通量,模型结果显示,蛤仔养殖区整体表现为中等尺度的碳汇,但存在一定的季节性差异。
总结起来,目前对于“滤食性贝类与碳的关系”的认识主要可以归结为三大类:一类是以“还原论”思维为底层逻辑支撑的观点。这种观点更多关注的是从化学角度来解析滤食性贝类对碳生物地球化学的影响,基于贝类的呼吸和生物钙化生理活动释放CO2过程,认为滤食性贝类是一个“碳源”(Chauvaud et al, 2003; Mistri et al, 2012; Munari et al, 2013),将视野仅仅聚焦在贝类驱动形成的碳网络的某一个或某几个过程,陷入了“只见树木,不见森林”的误区。另一类是以“整体论”思维为底层逻辑支撑的观点。这种观点主要强调“贝类贝壳中含有的碳可以长时间封存在贝壳内”这一结果,认为无论过程如何,贝壳中的碳来自于环境中,是碳的最终“出口”,忽视了贝类兼具的碳“源–汇”双重角色的复杂属性及碳迁移转化过程研究的重要性,陷入了“只见森林,不见树木”的误区。随着对于生态系统结构和功能认识的不断深入,越来越多的学者认识到,滤食性贝类作为自然或养殖生态系统中重要的生态类群,与浮游植物、浮游动物、营养盐、痕量元素等生物和非生物因素之间存在着极强的协同效应,在溶解无机碳、溶解有机碳、颗粒有机碳等不同形态碳的迁移转化方面有着非常复杂的过程和机制,需要以“既见树木、又见森林”的“系统论”思维为底层逻辑支撑,从生态系统层面对滤食性贝类养殖生态系统碳行为进行深入解析(Jiang et al, 2015; Filgueira et al, 2015、2019; 唐启升等, 2022)。
2 存在的主要问题目前,虽然对滤食性贝类和碳元素生物地球化学循环相互关系的研究取得了一些进展,但在支撑数据的数量和质量、监测技术、机理认知等方面尚存在局限性,距离达到“从生态系统层面刻画滤食性贝类养殖水域碳循环的影响并评估其碳汇效应”的层面尚有诸多工作亟需深化和拓展,具体表现在以下两个方面。
2.1 支撑数据的系统性和科学性亟需提升生理生态学研究是认识贝类与碳元素相互关系的重要途径,滤水率是量化贝类摄取颗粒有机碳(POC)的关键基础参数。从研究手段来说,滤水率的测定方法主要分为2种:室内静水法(Wang et al, 2015)和现场流水法(王晓芹等, 2019; Jiang et al, 2021)。以国际上广泛采用的现场流水法为例,主要存在3个亟需提升的方面:
一是滤水率测定结果的客观性和科学性不够。现有的水样处理方法多采用滤膜抽滤法,通过测定实验组和对照组水体中叶绿素或颗粒有机物的差值来计算滤水率,过滤水样体积的称量、水样的同步采集、抽滤过程滤膜的装卸等都需要人为的参与,而这些环节中微小滤膜碎片的掉落、不同操作人员对水样体积核定的偏差、多处理组模式下取样时间同步性欠缺等因素对实验结果都会带来较大影响,笔者研究团队近期采用现场流水法与便携式颗粒计数器(如PAMAS)测定相结合的方法取得了较好的实验结果(Jiang et al, 2021),后续结合正在进行的智能控制采样方法的研发,将使滤水率数据的全程机器化实时、批量获取成为可能,进而有效保障实验数据的客观性和科学性。
二是实验结果的标准化处理环节缺失。从目前已发表的很多研究报道来看,无论是基于静水法还是流水法,研究取得的实验数据后续处理严谨性不够,缺失了最终、也是最重要的数据标准化处理环节,使得即使是同一种类、相似条件下获得的实验结果仍然不具备可比性。
三是时间尺度需要加密。受限于实验手段和测定方法,研究过程中涉及到大量的人力、物力等要素投入,目前相关研究的时间尺度多为季节甚至年际尺度。滤食性贝类属于异速生长生物,生理过程与温度、所处的环境等随时变化的理化生物因素密切相关,季节尺度的测定数据对粗线条了解贝类生理过程虽然有一些帮助,但对于生理生态过程动态变化的揭示不够,在进入大数据时代的今天,月际、天甚至小时尺度海量数据的获取成为未来发展的必然趋势。
此外,水–气界面CO2交换研究的数据质量亦有待提升。水–气界面CO2交换研究是认识CO2在水与大气之间流动方向的重要参考(Raymond et al, 2013)。目前,对贝类养殖区海–气界面CO2交换的研究主要基于海–气界面CO2分压差(ΔpCO2)的方法,水体中pCO2的数据获取手段主要采用封闭体系(Jiang et al, 2014; Han et al, 2017)和走航观测(Han et al, 2021; Li et al, 2021)两大类。封闭体系通常水体较小,滤食性贝类强烈的摄食压力短时间就会对浮游植物群落结构造成压制,因此,这种方法难以体现出滤食性贝类所处生态系统中“贝类–浮游植物共同体”的相互作用。走航观测的方法对空间尺度的体现度较好,但存在的主要问题在于将不同时间点的数据放在了同一时间面上进行比较,易造成环境要素空间分布规律的解析失真。随着人们对于数据质量追求的不断推进,这种观测手段的局限性逐步显现,亟需发展一些涡度协
方差监测系统等实时的、广覆盖的新技术手段,这将为科学判断贝类养殖区局地性源汇格局提供重要参考。
2.2 机理认知亟需深化钙化过程是科研层面争论贝类是“碳源”还是“碳汇”的焦点,但对于钙化机理的认识仍然需要进一步深化。前文提及,目前广为熟知的钙化过程方程式为:
| $ \mathrm{Ca}^{2+}+2 \mathrm{HCO}_{3}^{-}=\mathrm{CaCO}_{3}+\mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} $ | (1) |
而实际上,钙化生物的钙化过程主要由相互关联的3个生化过程完成(McCulloch et al, 2017; Zhao et al, 2018a; Ross et al, 2019):
| $ \mathrm{HCO}_{3}^{-} \longrightarrow \mathrm{CO}_{3}^{2-}+\mathrm{H}^{+} $ | (2) |
| $ \mathrm{Ca}^{2+}+\mathrm{CO}_{3}^{2-} \longrightarrow \mathrm{CaCO}_{3} $ | (3) |
| $ \mathrm{H}^{+}+\mathrm{HCO}_{3}^{-} \longrightarrow \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} $ | (4) |
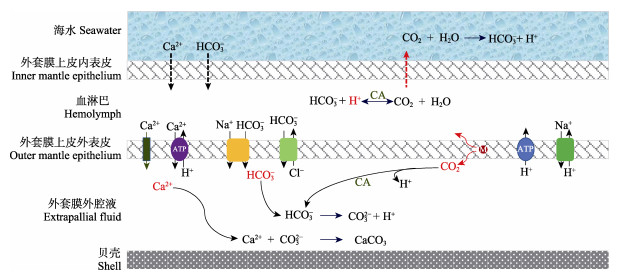
从单纯的化学方程式角度来说,(2)、(3)和(4)三个方程相加、去掉方程两侧的CO32–和H+,就得到了方程(1)。但生化过程不是简单的化学方程式,过程中的所有反应物、生成物都担负着各自重要的生物化学功能。外套膜外腔液、上皮细胞、血淋巴是完成钙化过程的几个关键介质,方程式两侧看起来相同的物质,其来源、所处的介质并不相同[如方程(2)和(3)发生在外套膜外腔液中,而方程(4)发生在血淋巴中],与代谢底物和终产物不同的是,中间产物兼具的“既是反应物又是生成物”双重角色精密串联起了细胞内外一系列的生化反应(图 4),因此,这些物质虽然是钙化过程的中间产物,但它们在细胞代谢层面发挥着非常重要的生物化学功能,不能从纯粹的化学角度进行简单删除、忽略它们的存在。
|
图 4 贝类钙化过程和机理示意图(改自Zhao et al, 2018a; Ross et al, 2019) Fig.4 Schematic diagram of the calcification process and mechanism for shellfish (Revised from Zhao et al, 2018a; Ross et al, 2019) |
从碳的途径来看,钙化过程的核心主要在于钙化底物HCO3−的来源。目前,将钙化过程碳的代谢一般归为无机碳代谢范畴,认为钙化底物HCO3−绝大部分来源于海水,个体碳收支方程的构建也主要基于这个认知(唐启升等, 2013; 姜娓娓等, 2022),但最近的研究发现,上皮细胞呼吸过程产生的CO2对于作为钙化底物的“HCO3−库”也具有重要的贡献。Zhao等(2018b)利用碳同位素技术对菲律宾蛤仔的研究发现,自然海水(pH 8.1)条件下呼吸产生的CO2对CaCO3形成的碳贡献度可达27%,而在酸化胁迫(pH 7.7)条件下,亲代和子一代呼吸产生的CO2对各自贝壳中碳的贡献度分别达到了45%和61%。滤食性贝类是变温动物,代谢强度随温度、饵料丰欠等环境因素动态变化,从钙化过程的角度来说,呼吸产生的CO2对贝壳CaCO3中碳的贡献度也因不同种类、不同生长阶段、不同区域而异。因此,这一机理的深入认识和量化对于修正、重构贝类碳收支方程将提供极为重要的科学依据,进而为从系统视角审视贝类在碳元素生物地球化学循环中的作用奠定数据基础。
3 展望滤食性贝类是我国海水养殖的主要种类,兼具重要的经济功能和生态服务功能。在我国全面推动“双碳”战略实施和“加快推进水产养殖业绿色高质量发展”的产业发展目标引领下,从碳视角深入挖掘养殖滤食性贝类承载的生态价值、拓展额外的经济价值具有重要的理论和现实意义,后续研究建议从滤食性贝类碳汇形成过程和机制的基础研究、方法学研发和交易体系建设、碳汇扩增模式构建和产业化应用等方面持续深入。
3.1 深化已知,探索未知针对目前滤食性贝类碳汇研究存在的支撑数据的科学性和系统性亟需提升、对关键过程和机理的认知不够深入等问题,以滤食性贝类驱动的碳在大气、水体环境、沉积物三大介质中的迁移转化过程为研究主线,综合运用室内模拟、走航观测、现场实验、数值模拟等多种技术手段,研发同步性、连续性、高通量核心参数测定和监测技术,深入解析双壳贝类生理代谢耦联碳库的动态变化、“贝类–浮游植物共同体”的互馈机理、海–气界面交换及其调控因素、养殖生态系统碳库储量等亟需深化和拓展研究的关键环节,从生态系统层面阐明滤食性贝类驱动的“使用碳”、“移出碳”、“储存碳”、“释放碳”4个碳库的动态变化过程及其调控机制。此外,随着技术手段的不断进步和机理认知的不断拓展,滤食性贝类介导的一些目前尚未知的碳汇途径也必将会不断被发现。
3.2 面向交易,方法先行在服务国家“双碳”战略的目标定位下,所有“碳汇”工作的努力都是面向“碳中和”,而“碳汇”与真正对“碳中和”产生实质性的贡献尚需要碳交易体系的衔接。目前,已有的一些相关行业标准受边界条件、方法等的制约,核算出的“碳汇”难以与碳交易体系认可的“碳汇”形成有效的衔接,在这样的背景下,严格遵循碳交易体系对于“碳汇”的界定,开发碳交易体系框架下的碳汇方法学尤为必要。建议科研院所、高等院校、方法学开发机构、碳资产机构等开展协同创新,积极探索渔业碳汇交易体系建设的行动框架和操作路径。
3.3 创新模式,拓展途径滤食性贝类与浮游植物间的互馈作用是否为良性是衡量滤食性贝类能否发挥碳汇功能的评判依据,这种良性的互馈需要养殖容量理论的支撑。因此,需要进一步发展养殖容量动态评估技术,建立健全养殖容量管理制度,在此基础上,研发、推广以滤食性贝类为核心生物功能群的多营养层次综合养殖模式,提高单位面积的生产效率,扩增贝类养殖碳汇。此外,随着海洋工程、港口航运、滨海旅游等用海产业对近海空间利用竞争的日益加剧以及养殖水域滩涂规划的逐步实施,作为海水养殖主战场的–20 m等深线以内浅海养殖空间日趋紧缩,以贝藻养殖为主体的碳汇渔业的发展受空间的制约越来越严重。因此,需要大力发展深水养殖工程装备科技,以工业化养殖技术、海洋工程装备技术为重点,进行关键技术创新、设施装备研发与系统模式集成,建立优质高效的养殖技术体系,拓展–20 ~ –40 m等深线深水养殖新空间,增加深水养殖碳汇。
BERTOLINI C, BERNARDINI I, BRIGOLIN D, et al. A bioenergetic model to address carbon sequestration potential of shellfish farming: Example from Ruditapes philippinarum in the Venice lagoon. ICES Journal of Marine Science, 2021, 78(6): 2082-2091 DOI:10.1093/icesjms/fsab099 |
CHAUVAUD L, THOMPSON J K, CLOERN J E, et al. Clams as CO2 generators: The Potamocorbula amurensis example in San Francisco Bay. Limnology and Oceanography, 2003, 48(6): 2086-2092 DOI:10.4319/lo.2003.48.6.2086 |
FANG J G, KUANG S H, SUN H L, et al. Study on the carrying capacity of Sanggou Bay for the culture of scallop Chlamys farreri. Marine Fisheries Research, 1996, 17(2): 18-31 [方建光, 匡世焕, 孙慧玲, 等. 桑沟湾栉孔扇贝养殖容量的研究. 海洋水产研究, 1996, 17(2): 18-31] |
FILGUEIRA R, BYRON C J, COMEAU L A, et al. An integrated ecosystem approach for assessing the potential role of cultivated bivalve shells as part of the carbon trading system. Marine Ecology Progress Series, 2015, 518: 281-287 DOI:10.3354/meps11048 |
FILGUEIRA R, STOHMEIER T, STRAND Ø. Regulating services of bivalve molluscs in the context of the carbon cycle and implications for ecosystem valuation. In: SMAAL A, FERREIRA J, GRANT J, et al (eds). Goods and services of marine bivalves. Springer, Cham, 2019
|
FRANKIGNOULLE M, CANON C, GATTUSO J P. Marine calcification as a source of carbon dioxide: Positive feedback of increasing atmospheric CO2. Limnology and Oceanography, 1994, 39(2): 458-462 DOI:10.4319/lo.1994.39.2.0458 |
HAN T T, SHI R J, QI Z H, et al. Impacts of large-scale aquaculture activities on the seawater carbonate system and air-sea CO2 flux in a subtropical mariculture bay, southern China. Aquaculture Environment Interactions, 2021, 13: 199-210 DOI:10.3354/aei00400 |
HAN T T, SHI R J, QI Z H, et al. Interactive effects of oyster and seaweed on seawater dissolved inorganic carbon systems: Implications for integrated multi-trophic aquaculture. Aquaculture Environment Interactions, 2017, 9(1): 469-478 |
JIANG W W, FANG J H, LIN F, et al. Evaluation on ecological carrying capacity and functions of Manila clam, Ruditapes philippinarum in Jiaozhou Bay. Progress in Fishery Sciences, 2022, 43(5): 61-71 [姜娓娓, 房景辉, 蔺凡, 等. 胶州湾菲律宾蛤仔生态容量评估及其碳汇功能. 渔业科学进展, 2022, 43(5): 61-71] |
JIANG W W, WANG X Q, RASTRICK S P S, et al. Effects of elevated pCO2 on the physiological energetics of Pacific oyster, Crassostrea gigas. ICES Journal of Marine Science, 2021, 78(7): 2579-2590 DOI:10.1093/icesjms/fsab139 |
JIANG Z J, FANG J G, HAN T T, et al. The role of Gracilaria lemaneiformis in eliminating the dissolved inorganic carbon released from calcification and respiration process of Chlamys farreri. Journal of Applied Phycology, 2014, 26: 545-550 DOI:10.1007/s10811-013-0110-8 |
JIANG Z J, FANG J G, WANG W, et al. Sea-air CO2 flux in Crassostrea gigas aquaculture area of East Gongjia Island, Rushan, Shandong, in autumn. Journal of Fisheries of China, 2012, 36(10): 1592-1598 [蒋增杰, 方建光, 王巍, 等. 乳山宫家岛以东牡蛎养殖水域秋季海-气界面CO2交换通量研究. 水产学报, 2012, 36(10): 1592-1598] |
JIANG Z J, LI J Q, QIAO X D, et al. The budget of dissolved inorganic carbon in the shellfish and seaweed integrated mariculture area of Sanggou Bay, Shandong, China. Aquaculture, 2015, 446: 167-174 DOI:10.1016/j.aquaculture.2014.12.043 |
LI J Q, ZHANG W W, DING J K, et al. Effect of large-scale kelp and bivalve farming on seawater carbonate system variations in the semi-enclosed Sanggou Bay. Science of the Total Environment, 2021, 753: 142065 DOI:10.1016/j.scitotenv.2020.142065 |
MCCULLOCH M T, DxOLIVO J P, FALTER J, et al. Coral calcification in a changing world and the interactive dynamics of pH and DIC upregulation. Nature Communications, 2017, 8: 15686 DOI:10.1038/ncomms15686 |
MISTRI M, MUNARI C. Clam farming generates CO2: A study case in the Marinetta lagoon (Italy). Marine Pollution Bulletin, 2012, 64(10): 2261-2264 DOI:10.1016/j.marpolbul.2012.07.010 |
MORRIS J P, HUMPHREYS M P. Modelling seawater carbonate chemistry in shellfish aquaculture regions: Insights into CO2 release associated with shell formation and growth. Aquaculture, 2019, 501: 338-344 DOI:10.1016/j.aquaculture.2018.11.028 |
MUNARI C, ROSSETTI E, MISTRI M. Shell formation in cultivated bivalves cannot be part of carbon trading systems: A study case with Mytilus galloprovincialis. Marine Environmental Research, 2013, 92: 264-267 DOI:10.1016/j.marenvres.2013.10.006 |
NIE M C, HUANG C L, SUI Q, et al. Carbon and nitrogen stable isotope analysis and source identification of organic matter in sediments of Sanggou Bay. Progress in Fishery Sciences, 2022, 43(5): 84-97 [聂梦晨, 黄翠玲, 隋琪, 等. 桑沟湾沉积物有机质的碳氮稳定同位素分析及其来源解析. 渔业科学进展, 2022, 43(5): 84-97] |
RAYMOND P A, HARTMANN J, LAUERWALD R, et al. Global carbon dioxide emissions from inland waters. Nature, 2013, 503: 355-359 DOI:10.1038/nature12760 |
REN L H. Research on carbon sequestration of cultured oyster Crassostrea gigas and its fouling organisms in Sungo Bay. Doctoral Dissertation of University of Chinese Academy of Sciences, 2014, 1-129 [任黎华. 桑沟湾筏式养殖长牡蛎及其主要滤食性附着生物固碳功能研究. 中国科学院大学博士研究生学位论文, 2014, 1-129]
|
ROSS C L, DECARLO T M, MCCULLOCH M T. Environmental and physiochemical controls on coral calcification along a latitudinal temperature gradient in Western Australia. Global Change Biology, 2019, 25(2): 431-447 DOI:10.1111/gcb.14488 |
TANG Q S, FANG J G, ZHANG J H, et al. Impacts of multiple stressors on coastal ocean ecosystems and integrated multitrophic aquaculture. Progress in Fishery Sciences, 2013, 34(1): 1-11 [唐启升, 方建光, 张继红, 等. 多重压力胁迫下近海生态系统与多营养层次综合养殖. 渔业科学进展, 2013, 34(1): 1-11 DOI:10.3969/j.issn.1000-7075.2013.01.001] |
TANG Q S, JIANG Z J, MAO Y Z. Clarification on the definitions and its relevant issues of fisheries carbon sink and carbon sink fisheries. Progress in Fishery Sciences, 2022, 43(5): 1-8 [唐启升, 蒋增杰, 毛玉泽. 渔业碳汇与碳汇渔业定义及其相关问题的辨析. 渔业科学进展, 2022, 43(5): 1-8] |
TANG Q S, HAN D, MAO Y Z, et al. Species composition, non-fed rate and trophic level of Chinese aquaculture. Journal of Fishery Sciences of China, 2016, 23(4): 729-758 [唐启升, 韩冬, 毛玉泽, 等. 中国水产养殖种类组成、不投饵率和营养级. 中国水产科学, 2016, 23(4): 729-758] |
TANG Q S, ZHANG J H, FANG J G. Shellfish and seaweed mariculture increase atmospheric CO2 absorption by coastal ecosystems. Marine Ecology Progress Series, 2011, 424: 97-104 DOI:10.3354/meps08979 |
TUROLLA E, CASTALDELLI G, FANO E A, et al. Life cycle assessment (LCA) proves that Manila clam farming (Ruditapes philippinarum) is a fully sustainable aquaculture practice and a carbon sink. Sustainability, 2020, 12(13): 1-12 |
WANG X Q, RASTRICK S P S, WU Y L, et al. Impact of seawater acidification on the energy budget of Mytilus galloprovincialis. Progress in Fishery Sciences, 2019, 40(3): 21-30 [王晓芹, Rastrick Samuel P. S., 吴亚林, 等. 海水酸化胁迫对紫贻贝能量分配的影响. 渔业科学进展, 2019, 40(3): 21-30] |
WANG Y J, LI L S, HU M H, et al. Physiological energetics of the thick shell mussel Mytilus coruscus exposed to seawater acidification and thermal stress. Science of the Total Environment, 2015, 514: 261-272 DOI:10.1016/j.scitotenv.2015.01.092 |
ZHANG J H, FANG J G, TANG Q S. The contribution of shellfish and seaweed mariculture in China to the carbon cycle of coastal ecosystem. Advances in Earth Science, 2005, 20(3): 359-365 [张继红, 方建光, 唐启升. 中国浅海贝藻养殖对海洋碳循环的贡献. 地球科学进展, 2005, 20(3): 359-365 DOI:10.3321/j.issn:1001-8166.2005.03.014] |
ZHANG Y P, QIN Z C, LI T T, et al. Carbon dioxide uptake overrides methane emission at the air-water interface of algae-shellfish mariculture ponds: Evidence from eddy covariance observations. Science of the Total Environment, 2022, 815: 152867 |
ZHAO L Q, MILANO S, WALLISER E O, et al. Bivalve shell formation in a naturally CO2-enriched habitat: Unraveling the resilience mechanisms from elemental signatures. Chemosphere, 2018a, 203(1): 132-138 |
ZHAO L Q, YANG F, MILANO S, et al. Transgenerational acclimation to seawater acidification in the Manila clam Ruditapes philippinarum: Preferential uptake of metabolic carbon. Science of the Total Environment, 2018b, 627: 95-103 |



