2. 青岛海洋科学与技术试点国家实验室 山东 青岛 266071;
3. 莱州明波水产有限公司 山东 莱州 261400;
4. 天津农学院水产学院 天津 300384
2. Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. Mingbo Aquatic Co. Ltd, Laizhou, Shandong 261400, China;
4. College of Fisheries, Tianjin Agricultural University, Tianjin 300384, China
温度是影响水生生物生长和存活的重要环境因子之一,鱼类作为水生变温动物,温度的突变会对其机体正常的生理活动产生显著的影响(许友卿等, 2010; 龙华, 2005; 杨凯等, 2020)。鱼类种属多样,其对温度耐受的生理阈值既存在种属间差异,又受到生存环境的影响。一般而言,温水性鱼类具有较高的耐高温性能,而冷水性鱼类则获得了较强的抗低温能力,对高温变化反应敏感。冷水性鱼类如虹鳟(Oncorhynchus mykiss)、小黄鱼(Larimichthys polyactis)在较高的温度环境下,生长发育受到抑制,甚至引起死亡,而温水性鱼类具有更强的耐高温能力(龙华, 2005; 南鸥, 2017)。鱼类经过环境适应性进化和定向选育,可获得更为宽泛的高温耐受范围。马爱军等(2012)对冷水型鱼类大菱鲆(Scophthalmus maximus L.)进行了2代选育,发现耐高温家系筛选后的选育二代耐温性比选育一代提高了1~2℃。卢钟磊等(2007)进行牙鲆(Paralichthys olivaceus)耐高温辅助选育,显著提升了其后代耐温能力,同时在黄锡鲷(Rhabdosargus sarba)、鲢(Hypophthalmichthys molitrix)、草鱼(Ctenopharyngodon idellus)和尼罗罗非鱼(Oreochromis niloticus)等鱼中进行耐高温研究(Deane et al, 2005; 何珊等, 2009)。大量研究表明,高温胁迫引起鱼类血液皮质醇(COR)、葡萄糖(GLU)等生理生化指标发生显著改变,进而影响机体正常生理状态(文鑫, 2019; 刘波, 2012; 强俊等, 2012)。同时,热休克蛋白(heat shock proteins, HSPs)作为一种重要的分子伴侣蛋白,广泛参与了热应激诱导的分子调控网络,其中,hsp70和hsp90在维持氨基酸三级结构正常有序折叠,在清除受损而无法修复蛋白过程中发挥重要作用(Jia et al, 2020; Meakin et al, 2014),大量表达的hsp70和hsp90可增强细胞对热应激的耐受性,提高细胞的存活率,避免机体遭受损害(Lombard, 2010; Genest et al, 2019)。
斑石鲷(Oplegnathus punctatus)主要分布于中国、朝鲜和日本的温热带海域。斑石鲷不仅体态优美,而且肉质鲜美、营养价值和药用价值极高,其生长速度快,抗逆性强,适温范围为22~28℃,生存水温为6~32℃,是一种具有养殖前景的优良经济鱼类(尤宏争等, 2015; 张宏祥等, 2020)。2014年,山东莱州明波水产有限公司与中国科学院海洋研究所、中国水产科学研究院黄海水产研究所合作成功培育出批量斑石鲷苗种,填补了我国斑石鲷苗种繁育的空白。围栏养殖是指利用网衣、桩柱、绳链等先进工程设施在开放水域圈围形成较大水域空间,既能保持水域生态系统相对稳定,又能符合可持续发展要求,是鱼类等水产经济动物的一种重要的养殖方式,是人类主动定向利用海洋生物资源、拓展海洋水产业发展空间的重要途径之一,具有养殖效益好与产品品质高等优势,是目前深远海养殖的主要模式之一(周文博等, 2018)。邹国华等(2021)研究发现,围栏养殖模式下大黄鱼(Larimichthys crocea)品质更优,且市场售价更高。目前,在我国北方黄渤海海域,由于北方冬季严寒,海域水温低,斑石鲷需要在秋末冬初由围栏转运至工厂化车间进行越冬保育,待到来年春末夏初水温升高再转运至外海围栏进行陆海接力养殖。前期研究发现,大规格斑石鲷经过围栏养殖获得了较高存活率和生长性能,同时,其生理状态得到显著提升(Jia et al, 2021)。斑石鲷在围栏养殖过程中,需要经历夏季高温,海水温度过高会导致其摄食减少、抗病力下降,且水温的上升有利于病原微生物生长和传播,诱导疾病的发生。目前,有关斑石鲷耐高温研究尚未有系统报道,在高温胁迫过程中相应生理生化反应和响应机制也尚不明确。基于此,本研究选取2种不同规格斑石鲷,以围栏养殖海域夏季最高温度为上限,通过陆基生态模拟实验,查明其在急性高温胁迫下呼吸频率变化规律,分析其血液生理生化指标和肝脏中hsp70、hsp90 mRNA的表达变化,以期为斑石鲷围栏高效养殖提供技术支撑。
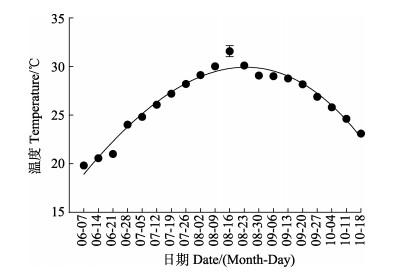
1 材料与方法 1.1 实验材料与设计通过水质监测仪(Aqua TROLL 500, 美国)实时监测围栏养殖海域水温度变化,每小时监测1次,温度实时上传到后台数据库中,统计6—10月围栏海域温度变化。夏季海水最高温度为(31.57±0.57)℃(图 1),基于此,本实验温度上限选择32.0℃。实验在山东烟台莱州明波水产有限公司进行,小规格斑石鲷体重为(45.56±5.29) g,大规格斑石鲷体重为(183.65±15.99) g,实验前在养殖水桶(桶径80 cm,桶深75 cm,体积0.4 m3)暂养2周,养殖水温为(25.0±0.5)℃,盐度为32,pH为7.5±0.2,溶解氧浓度 > 7.00 mg/L,氨氮浓度 < 0.1 mg/L,暂养期间正常投喂。正式实验前,禁食24 h。预实验发现,32℃处理6.5 h后,2种规格斑石鲷呼吸频率基本稳定,本实验以25℃为对照组,32℃为实验组,2种规格斑石鲷进行2次实验,每次设置1个对照组(0 h)和5个实验组,实验组分别为高温处理1、3、6 h和高温处理6 h恢复至正常水温25℃后6 h (R6)、12 h (R12),每组设3个平行,共18个养殖水桶,每桶放置10尾鱼,利用热电厂余热通过管道将循环水储水池温度升高至32℃,将水通入养殖水桶,5 min后水温维持在(32.0±0.5)℃。高温处理1、3和6 h后,调整管道加热系统,20 min内将水温逐渐调整恢复至25℃,恢复25℃后6、12 h时每桶各选取3尾鱼,实验期间保持溶氧充足。具体温度应激和恢复试验操作见图 2。
|
图 1 围栏养殖海域海水温度变化 Fig.1 Changes of sea water temperature in offshore aquaculture net pen |

|
图 2 斑石鲷高温应激和恢复实验示意图 Fig.2 Scheme of thermal stress and recovery experiment in spotted knifejaw |
预实验发现,在高温胁迫30 min内,斑石鲷出现显著的呼吸运动行为变化,实验开始前期每隔10 min采用宋文华等(2012)的实验方法,记录其10 s内的呼吸次数,鱼体稳定后期每隔30 min观察鱼的呼吸频率,即每分钟鱼鳃的呼吸次数,并及时观察鱼的状态,记录在高温环境下不同时间的呼吸频率、异常行为及存活状态。采用浓度200 mg/L的MS-222将实验鱼快速深度麻醉,使用1 mL一次性注射器对麻醉处理过的斑石鲷进行尾静脉采血,血样分为2份,一份直接用于检测白细胞(white blood cell, WBC)、红细胞(red blood cell, RBC)、血红蛋白(hemoglobin, HGB)和红细胞积压(hematocrit, HCT);一份静置1 h后在4℃下以3000 r/min速率离心10 min,收集血清放于–20℃冰箱保存,检测葡萄糖和皮质醇含量。取肝、鳃组织存于RNAStore (TIANGEN)备用,检测热休克蛋白(hsp70、hsp90)的表达。
1.3 测定指标与方法 1.3.1 血液生理生化指标测定斑石鲷血清皮质醇采用上海酶联生物研究所酶联免疫吸附试剂盒(ELISA, ml024863)进行检测。葡萄糖测定试剂盒(F006-1-1)购自南京建成有限公司,采用微板法进行测定。斑石鲷血液学指标使用迈瑞全自动血液细胞分析仪(BC-2800vet)进行监测,包括WBC、RBC、HGB、HCT数据。
1.3.2 肝脏hsp70、hsp90 mRNA表达根据本研究团队对斑石鲷进行全基因组测序所得序列设计引物(表 1),选用β-actin作为内参,所有引物由生工生物工程(上海)有限公司合成,采用Trizol试剂(GIBCO-BRL, 美国)提取斑石鲷肝脏组织RNA,采用1%琼脂糖凝胶电泳和NanoDrop2000超微量分光光度计对总RNA的质量和浓度进行分析。每个样本的总RNA (1 μg)通过带有消除cDNA的PrimeScriptTMRT试剂盒进行反转录(TaKaRa Biotech)。所得cDNA用无菌去离子水稀释10倍(1∶10)。使用Applied Biosystems 7500型实时荧光定量PCR仪进行qRT-PCR。总反应体积为20 μL,包括10 μL SYBR® Premix Ex Taq Ⅱ(TaKaRa Biotech)、2 μL cDNA样本、0.8 μL正向/反向PCR引物(10 μmol/L)、0.4 μL ROX染料(50×)引物和6 μL无核酸酶水。反应程序:95℃ 30 s,然后95℃ 10 s,60℃ 30 s,40个循环。每个实验中还包括无cDNA的阴性对照。
|
|
表 1 实时荧光定量PCR引物 Tab.1 Quantitative real-time PCR primers |
实验数据利用SPSS 18.0软件进行数据分析,采用单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA),用LSD和Duncan′s多重比较进行组间差异比较,P < 0.05时表示差异显著,实验结果用平均值±标准误(Mean±SE)表示。
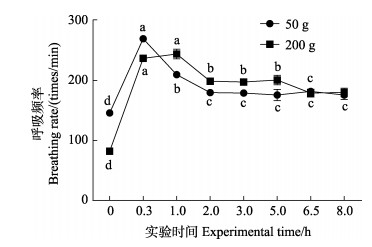
2 结果与分析 2.1 急性高温胁迫对斑石鲷呼吸频率的影响32℃高温条件下,2种规格斑石鲷呼吸频率呈先升高后降低的变化趋势,其中,50 g斑石鲷0.3 h (20 min)时呼吸频率达最高值(P < 0.05),随后显著降低,2 h后趋于平稳。200 g斑石鲷呼吸频率呈梯度性变化趋势,高温胁迫期间呼吸频率一直维持在较高水平,0.3 h (20 min)时显著升高,1 h时呼吸频率达最高值(P < 0.05),随后显著下降(P < 0.05) (图 3)。
|
图 3 2种规格斑石鲷呼吸频率变化 Fig.3 Changes of respiratory frequency in two sizes of spotted knifejaw 不同小写字母表示显著性差异(P<0.05, n=10)。下同。 The significant differences are shown in different lower-case letters (P<0.05, n=10). The same as below. |
2种规格斑石鲷COR含量皆呈先升高后降低的变化趋势(图 4A),高温处理1 h后显著升高(P < 0.05)。其中,50 g斑石鲷COR浓度1 h时显著高于其他处理组(P < 0.05),200 g斑石鲷COR浓度在1 h时显著低于50 g斑石鲷血清COR浓度(P < 0.05),恢复6 h后,COR浓度与对照组相比无显著差异(P > 0.05)。且2种规格斑石鲷血清COR含量受鱼体规格、时间以及时间与鱼体规格交互作用的显著影响(P < 0.05)。

|
图 4 急性高温胁迫和恢复过程中2种规格斑石鲷血清皮质醇、葡萄糖浓度变化 Fig.4 Changes of serum cortisol and glucose concentrations of two sizes of spotted knifejaw during acute thermal stress and recovery “*”表示差异性显著(P<0.05);“/”表示差异性不显著(P>0.05)。 “*”: Significant difference by the Two-way ANOVA analysis (P<0.05); “/”: No significant difference (P>0.05). Same letters on the column represent no significant difference. |
2种规格斑石鲷GLU浓度皆呈先升高后降低的趋势(图 4B)。其中,50 g斑石鲷GLU浓度6 h时显著高于其他处理组(P < 0.05),恢复6 h时与对照组无显著差异(P > 0.05)。相较于50 g斑石鲷,200 g斑石鲷GLU浓度在高温胁迫期间一直处于较高水平,恢复12 h时与对照组无显著差异(P > 0.05)。且2种规格斑石鲷血清GLU含量受鱼体规格、时间显著影响(P < 0.05)。
2.3 急性高温胁迫对斑石鲷血液学的影响50 g斑石鲷WBC、RBC数目、HGB含量均呈先上升后下降的趋势(表 2),3 h时达到最大值,WBC、HGB在恢复12 h后未恢复正常水平;HCT处理组与对照组无显著差异(P > 0.05)。200 g斑石鲷WBC处理组与对照组无显著差异(P > 0.05),RBC、HCT处理组与对照组呈现显著性波动(P < 0.05),HGB呈先上升后下降的趋势(表 2),3 h时显著高于对照组(P < 0.05),恢复12 h时显著低于对照组(P < 0.05)。
|
|
表 2 急性高温胁迫和恢复过程中2种规格斑石鲷血液指标变化 Tab.2 Hematology of two sizes spotted knifejaw during acute high temperature stress and recovery |
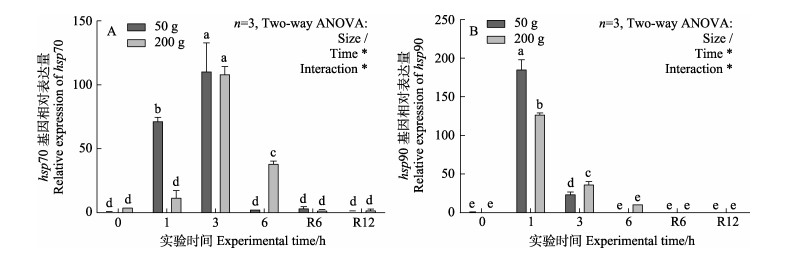
2种规格斑石鲷在急性高温(32℃)胁迫下,肝脏组织中hsp70和hsp90 mRNA表达皆呈先上升后下降的趋势。hsp70 mRNA表达量受时间以及时间与鱼体规格交互作用的显著影响(图 5A),hsp70 mRNA在3 h时表达量最高,后显著下降,其中,50 g斑石鲷在胁迫6 h时与对照组无显著差异(P > 0.05),200g斑石鲷恢复6 h时与对照组相比无显著差异(P > 0.05)。2种规格斑石鲷hsp90 mRNA受鱼体规格、时间以及时间与鱼体规格交互作用的显著影响(图 5B),hsp90 mRNA表达量1 h时达到最高(P < 0.05),后显著下降,高温胁迫6 h时与对照组相比无显著差异(P > 0.05)。
|
图 5 高温胁迫和恢复过程中2种规格斑石鲷肝脏hsp70、hsp90 mRNA表达变化 Fig.5 Changes in the expression of hepatic hsp70 and hsp90 mRNA of two sizes of spotted knifejaw during acute thermal stress and recovery |
鱼类呼吸主要受体重和水温等因素影响,温度上升使呼吸频率增加是由于代谢率增加所致,水温升高,鱼体新陈代谢旺盛,体内氧化过程增强,气体交换频繁,因此,呼吸频率增加。本研究中,2种不同规格的斑石鲷在32℃高温胁迫条件下,呼吸频率显著升高,表明斑石鲷在高温刺激下,通过提高呼吸频率,增加机体氧供应量,提高有氧代谢水平,满足高温导致的基础代谢增加。一般而言,高温环境下,鱼类规格越大,其体内代谢需求量就越大,呼吸频率波动就越剧烈,对高温环境适应性越差(何林强等, 2020)。本研究也发现,50 g斑石鲷呼吸频率在高温应激0.3 h (20 min)后趋于平稳,而200 g斑石鲷呼吸频率则呈梯度性变化趋势,一直维持在较高水平且增加幅度高于50 g斑石鲷,二者呼吸频率变化规律显著不同,这表明不同规格的斑石鲷在应对高温胁迫过程中,大规格斑石鲷对高温刺激,其呼吸行为更加敏感,小规格的斑石鲷对高温的耐受适应性更强。陈进树(2007)和何林强等(2020)对神仙鱼(Pterophyllum scalare)和拉萨裂腹鱼(Schizotjorax waltoni)的温度耐受研究中也得到类似结果。
3.2 急性高温胁迫对斑石鲷血清皮质醇和葡萄糖水平的影响鱼类的血液指标始终处于动态平衡中,血液指标的变化直接反映了鱼类应对外界环境变化的内分泌水平和代谢情况(张亚晨等, 2015)。GLU作为直接能源物质,可以为机体的各项生命活动提供能量,COR浓度的升高可被看作是鱼类收到应激胁迫的信号。温度作为极其重要的环境因子,对血液生理指标的影响尤其明显,研究发现﹐当鱼类处于温度胁迫状态时,血清GLU和COR含量有上升趋势(刘波, 2012)。同时,当水环境温度发生急剧变化时,会刺激鱼类下丘脑–垂体–肾上腺皮质轴(HPR)释放COR进入到循环系统中,血浆中的高水平COR促使肝糖原发生糖酵解,加速GLU浓度上升,满足高温胁迫下由于呼吸速率、代谢水平的上升而产生的对能量的更高需求(崔学升等, 2010)。对于大多数硬骨鱼类,血清COR和GLU水平在经过外界刺激后的短时间内会迅速恢复,从而维持机体的正常生理状况(Costas et al, 2011)。对罗非鱼(Oreochromis mossambicus)进行高温处理,结果显示,GLU含量显著上升(彭婷等, 2012),将尼罗罗非鱼从26℃转移至35℃水中胁迫24 h,血清COR和GLU水平也明显增加(强俊等, 2012)。本研究中,2种规格斑石鲷在32℃高温环境下,COR水平迅速增加,胁迫1 h时达到最高值,GLU水平升高相对较为缓慢,在胁迫6 h时达到最高。COR含量的增加会使机体各组织对葡萄糖的利用率降低,肝脏糖异生作用加强,导致GLU升高,为机体应对高温应激提供更多能量供应,维持正常生理代谢(Perez et al, 2008)。且小规格斑石鲷胁迫1 h后COR水平显著下降,大规格斑石鲷在高温胁迫期间COR含量无大幅度波动,1 h时血清COR浓度显著低于小规格斑石鲷(P < 0.05),这可能是因为小规格斑石鲷具有更高耐高温性能,能够更快地响应外界环境变化。同时,小规格斑石鲷GLU恢复6 h即可与对照组相比无显著差异(P > 0.05),而大规格斑石鲷GLU水平恢复正常水平需12 h,这可能是因为大规格斑石鲷在应对高温胁迫过程中需要动员更多的能量来补偿基础代谢消耗。
3.3 急性高温胁迫对斑石鲷血液生理指标的影响水温是主要影响鱼类血液中RBC数量的因素(Collazos et al, 1998)。本研究发现,2种规格斑石鲷血液中RBC、HGB水平皆呈先上升后下降的趋势,在胁迫3 h达到最高值,恢复12 h时RBC与对照组相比无差别(P > 0.05),小规格斑石鲷HGB显著低于对照组(P < 0.05),大规格斑石鲷HGB显著高于对照组(P < 0.05)。这与许氏平鲉耐高温的结果一致(张亚晨等, 2015),这可能是因为当水温升高时,鱼类新陈代谢增强,对氧的需求量增加,HGB含量和RBC数量代偿性增加,提供更多氧气。WBC作为鱼类机体细胞免疫和体液免疫的重要成分,主要作用是保护机体抵御外部和内部的伤害(Collazos et al, 1998)。同时,鱼类外周血中的WBC也是机体细胞免疫和体液免疫的重要成分(王艺等, 2018)。鱼体受到急性温度胁迫后,血液中WBC数量发生改变,表明机体免疫机能受到影响(薛家华等, 1995)。对体重为(879.03±22.61) g许氏平鲉(张亚晨等, 2015)与体重为(406.9±41.5) g许氏平鲉(温海深等, 2016)的耐高温研究发现,高温胁迫时,WBC数量皆显著上升以抵御高温突变环境。本研究发现,小规格斑石鲷(50 g) WBC呈先上升后下降的趋势,恢复12 h后显著高于对照组(P < 0.05),这可能是由于恢复时间较短,血液中WBC未恢复正常水平。200 g斑石鲷血液中WBC未发生显著变化(P > 0.05),可能是因为小规格斑石鲷的生理代谢旺盛,对环境刺激诱导的生理响应更加迅速,显著提高血液WBC数量,增强机体防御,以应对高温刺激可能引发的生理损伤,而大规格斑石鲷对高温刺激反应则相对滞后,急性高温胁迫未引起血液WBC发生显著变化。红细胞积压(HCT)水平在营养不良或感染性疾病的情况下经常波动(虞为等, 2019),本研究发现,小规格斑石鲷血液中HCT在高温胁迫下未发生显著变化(P > 0.05),200 g斑石鲷呈现显著性波动(P < 0.05),这表明在高温胁迫刺激下小规格斑石鲷相较于大规格斑石鲷更耐受。
3.4 急性高温胁迫对hsp70和hsp90 mRNA表达水平的影响热休克蛋白作为重要的分子伴侣蛋白,参与调控不同应激源诱导的脊椎动物的遗传变异(Huang et al, 2014)。热休克蛋白的主要功能是作为一个缓冲体,修复错误折叠,限制聚集,降低环境和遗传变异对蛋白质组的影响(Jacob et al, 2017)。在热休克蛋白中,hsp70和hsp90作为分子伴侣,可以协助新生多肽链的折叠,介导变性蛋白的修复和降解(Luengo et al, 2019)。hsp70和hsp90基因的表达容易受环境应激源影响,可用来评估生物体对环境应激源的反应(Dalvi et al, 2017; Hassan et al, 2019)。高温刺激下,团头鲂(Megalobrama amblycephala)、暗纹东方鲀(Takifugu obscurus)、湖鳟(Salvelinus namaycush)、草鱼和大菱鲆hsp90和hsp70 mRNA表达发生显著改变(Liu et al, 2016; Cheng et al, 2018; Kelly et al, 2017; Cui et al, 2014; Huang et al, 2020)。本研究也得到类似结果,在32℃高温应激下,2种规格斑石鲷肝脏中hsp70和hsp90 mRNA表达量均呈先上升后下降的趋势,在应激初期均呈显著性增加(P < 0.05),表明斑石鲷会通过提高hsp70、hsp90 mRNA的表达来应对机体的应激状况,这是增强自身细胞对热应激的耐受性、提高细胞的存活率、保护机体不受或少受损害的表现(Lombard, 2010)。高温胁迫3 h后,2种规格斑石鲷hsp70 mRNA的表达显著下降(P < 0.05),hsp90 mRNA在胁迫6 h时的表达量显著低于胁迫3 h (P < 0.05),这可能因为热应激对hsp70、hsp90 mRNA的表达具有一定时间累积效应,随着应激时间延长,细胞膜结构损伤与蛋白质结构改变,导致hsp70、hsp90无法继续转录,表达量降低(刘波, 2016; 陈明帅等, 2012)。在团头鲂(刘波, 2016)、许氏平鲉(温海深, 2016)和银鲫(Carassius auratus gibelio) (周朝伟等, 2018)耐高温研究中也报道了类似结果。双因素方差分析结果也显示,hsp70和hsp90 mRNA表达量均受时间与规格交互作用的显著影响,表明肝脏中hsp70和hsp90 mRNA的表达受鱼体规格大小的影响,且热应激1 h时,小规格斑石鲷(50 g)肝脏中hsp70和hsp90 mRNA表达量显著高于大规格斑石鲷(200 g) (P < 0.05),这表明小规格斑石鲷对于高温胁迫体内响应时间较早,敏感性显著高于大规格斑石鲷。
4 结论综上所述,本研究证实了高温对2种规格斑石鲷呼吸频率、血液生理生化指标和肝脏hsp70、hsp90 mRNA表达产生显著的影响。结果表明,急性高温应激显著增加了2种不同规格斑石鲷的呼吸频率、血清皮质醇和葡萄糖含量,上调hsp70和hsp90 mRNA表达,恢复正常水温12 h后,上述指标逐渐恢复正常,与对照组相比无显著差异。同时,小规格的斑石鲷在应对高温胁迫过程中,具有更强的适应调节能力。相关结果可为大型围栏养殖模式下斑石鲷高效养殖提供有效数据支撑,同时也为进一步阐明斑石鲷高温耐受调控机制奠定了基础。
CHEN J S. Influence of temperature on the digestive enzyme activity and respiration frequency of Pterophyllum scalare. Master´ s Thesis of Xiamen University, 2007, 28-30 [陈进树. 温度对神仙鱼(Pterophyllum scalare)主要消化酶活力及呼吸频率的影响. 厦门大学硕士研究生学位论文, 2007, 28-30] |
CHEN M S, XU C, SONG X C, et al. Advances on heat shock protein. Journal of Economic Animal, 2016, 20(1): 44-53 [陈明帅, 徐超, 宋兴超, 等. 热休克蛋白的研究进展. 经济动物学报, 2016, 20(1): 44-53 DOI:10.13326/j.jea.2016.1116] |
CHENG C H, GUO Z X, LUO S W, et al. Effects of high temperature on biochemical parameters, oxidative stress, DNA damage and apoptosis of pufferfish (Takifugu obscurus). Ecotoxicology and Environmental Safety, 2018, 150: 190-198 DOI:10.1016/j.ecoenv.2017.12.045 |
COLLAZOS M E, ORTEGA E, BARRIGA C, et al. Seasonal variation in hematological parameters in male and female Tinca tinca. Molecular and Cellular Biochemistry, 1998, 183(1/2): 165-168 DOI:10.1023/A:1006878922332 |
COSTAS B, CONCEICAO L E, ARAGAO C, et al. Physiological responses of Senegalese sole (Solea senegalensis Kaup, 1858) after stress challenge: Effects on non-specific immune parameters, plasma free amino acids and energy metabolism. Aquaculture, 2011, 316(1): 68-76 |
CUI X S, ZHOU C W, LI Z Q. Fasting and heat stress test on biochemical indexes of Schizothorax prenanti. Feed Research, 2010(2): 63-65 [崔学升, 周朝伟, 李志琼. 禁食和热应激对齐口裂腹鱼生化指标的试验. 饲料研究, 2010(2): 63-65 DOI:10.13557/j.cnki.issn1002-2813.2010.02.026] |
CUI Y T, LIU B, XIE J, et al. The effect of hyperthermia on cell viability, oxidative damage, and heat shock protein expression in hepatic cells of grass carp (Ctenopharyngodon idellus). Fish Physiology and Biochemistry, 2014, 40(3): 355-361 |
DALVI S R, DAS T, DEBNATH D, et al. Metabolic and cellular stress responses of catfish, Horabagrus brachysoma (Günther) acclimated to increasing temperatures. Journal of Thermal Biology, 2017, 65: 32-40 DOI:10.1016/j.jtherbio.2017.02.003 |
DEANE E E, WOO N Y S. Cloning and characterization of the hsp70 multigene family from silver sea bream: Modulated gene expression between warm and cold temperature acclimation. Biochemical and Biophysical Research Comunications, 2005, 330(3): 776-783 DOI:10.1016/j.bbrc.2005.03.039 |
GENEST O, WICKNER S, DOYLE S M. Hsp90 and Hsp70 chaperones: Collaborators in protein remodeling. Journal of Biological Chemistry, 2019, 294(6): 2109-2120 DOI:10.1074/jbc.REV118.002806 |
HASSAN F, NAWAZ A, REHMAN M S, et al. Prospects of HSP70 as a genetic marker for thermo-tolerance and immuno-modulation in animals under climate change scenario. Animal Nutrition, 2019, 5(4): 340-350 DOI:10.1016/j.aninu.2019.06.005 |
HE L Q, WANG W L, ZENG B H, et al. The study on the temperature tolerance of different sizes of Schizotjorax waltoni. Acta Hydrobiologica Sinica, 2020, 44(6): 1230-1238 [何林强, 王万良, 曾本和, 等. 不同规格拉萨裂腹鱼温度耐受性研究. 水生生物学报, 2020, 44(6): 1230-1238] |
HE S, LIANG X F, LI G G, et al. Cloning and analysis of the full-length cDNA sequences of the heat shock protein 70 gene from silver carp, grass carp and Nile tilapia. Acta Scientiae Circumstantiae, 2009, 29(11): 2324-2330 [何珊, 梁旭方, 李观贵, 等. 鲢鱼、草鱼和尼罗罗非鱼热休克蛋白70基因cDNA全长序列的克隆与分析. 环境科学学报, 2009, 29(11): 2324-2330 DOI:10.3321/j.issn:1672-2043.2009.11.020] |
HUANG Z H, MA A J, WANG X A, et al. The interaction of temperature, salinity and body weight on growth rate and feed conversion rate in turbot (Scophthalmus maximus). Aquaculture, 2014, 432: 237-242 DOI:10.1016/j.aquaculture.2014.04.013 |
HUANG Z H, MA A J, YANG S S, et al. Transcriptome analysis and weighted gene co-expression network reveals potential genes responses to heat stress in turbot Scophthalmus maximus. Comparative Biochemistry and Physiology, Part D: Genomics and Proteomics, 2020, 33: 100632 DOI:10.1016/j.cbd.2019.100632 |
JACOB P, HIRT H, BENDAHMANE A. The heat-shock protein/chaperone network and multiple stress resistance. Plant Biotechnology Journal, 2017, 15(4): 405-414 DOI:10.1111/pbi.12659 |
JIA Y D, CHEN X T, WANG Z Y, et al. Physiological response of juvenile turbot (Scophthalmus maximus L.) during hyperthermal stress. Aquaculture, 2020, 529: 735645 DOI:10.1016/j.aquaculture.2020.735645 |
JIA Y D, GAO Y T, GAO Y H, et al. Growth performance, hematological and biochemical parameters, and hepatic antioxidant status of spotted knifejaw Oplegnathus punctatus in an offshore aquaculture net pen. Aquaculture, 2021, 541: 736761 DOI:10.1016/j.aquaculture.2021.736761 |
KELLY N I, WILSON C C, CURRIE S, et al. Acclimation capacity of the cardiac HSP70 and HSP90 response to thermal stress in lake trout (Salvelinus namaycush), a stenothermal ice-age relict. Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology, 2017, 224: 53-60 |
LIU B, XU P, BROWN P B, et al. The effect of hyperthermia on liver histology, oxidative stress and disease resistance of the Wuchang bream, Megalobrama amblycephala. Fish and Shellfish Immunology, 2016, 52: 317-324 DOI:10.1016/j.fsi.2016.03.018 |
LIU B. Effects of high temperature stress and anthraquinone extract from rheum officinale bail on the physiological response and gene expression of stress heat shock protein of Wuchang bream (Megalobrama amblycephala). Doctoral Dissertation of Nanjing Agricultural University, 2012 [刘波. 高温应激与大黄蒽醒提取物对团头纺生理反应及相关应激蛋白表达的影响. 南京农业大学博士研究生学位论文, 2012]
|
LOMBARD J H. Depression, psychological stress, vascular dysfunction, and cardiovascular disease: thinking outside the barrel. Journal of Applied Physiology, 2010, 108(5): 1025-1026 DOI:10.1152/japplphysiol.00203.2010 |
LONG H. The effect of temperature on fish survival. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2005(S1): 254-257 [龙华. 温度对鱼类生存的影响. 中山大学学报(自然科学版), 2005(S1): 254-257] |
LU Z L, CHI X C, WANG Y Q, et al. The screening of microsatellites molecular markers with correlationship to heat-resistance of Paralichthys olivaceus. Journal of Xiamen University (Natural Science), 2007, 46(3): 396-402 [卢钟磊, 池信才, 王义权, 等. 褐牙鲆耐热性状相关的微卫星分子标记筛选. 厦门大学学报(自然科学版), 2007, 46(3): 396-402 DOI:10.3321/j.issn:0438-0479.2007.03.022] |
LUENGO T M, MAYAR M P, RUDIGER S G D, et al. The Hsp70-Hsp90 chaperone cascade in protein folding. Trends in Cell Biology, 2019, 29(2): 164-177 DOI:10.1016/j.tcb.2018.10.004 |
MA A J, HUANG Z H, WANG X A, et al. The selective breeding of thermal tolerance family and appraisal of performance in turbot Scophthalmus maximus. Oceanologia et Limnologia Sinica, 2012, 43(3): 797-804 [马爱军, 黄智慧, 王新安, 等. 大菱鲆(Scophthalmus maximus)耐高温品系选育及耐温性能评估. 海洋与湖沼, 2012, 43(3): 797-804] |
MEAKIN C A, QIN J G, POGSON L D, et al. Thermal tolerance in juvenile King George whiting (Sillaginodes punctata) reduces as fish age and this reduction coincides with migration to deeper colder water. Comparative Biochemistry and Physiology, Part A Molecular and Integrative Physiology, 2014, 172: 46-51 DOI:10.1016/j.cbpa.2014.02.016 |
NAN O. Study on the thermal tolerance of the common nektons in Shidao Bay, Yellow Sea. Master´s Thesis of Institute of Oceanology Chinese Academy of Sciences, 2017 [南鸥. 石岛湾常见游泳动物的热耐受性研究. 中国科学院大学(中国科学院海洋研究所)硕士研究生学位论文, 2017]
|
PENG T, HU T J, LIN Y, et al. Effects of low temperature stress on indices of biochemistry, immunity and antioxidation in Nile tilapia. Fisheries Science, 2012, 31(5): 259-263 [彭婷, 胡庭俊, 林勇, 等. 低温胁迫对罗非鱼血液生化、免疫及抗氧化指标的影响. 水产科学, 2012, 31(5): 259-263] |
PEREZ C, RISE M L, DIXON B, et al. The immune and stress responses of Atlantic cod to long-term increases in water temperature. Fish and Shellfish Immunology, 2008, 24(5): 600-609 DOI:10.1016/j.fsi.2008.01.012 |
QIANG J, YANG H, WANG H, et al. The effect of acute temperature stress on biochemical indices and expression of liver HSP70 mRNA in gift Nile tilapia juveniles (Oreochromis niloticus). Oceanologia et Limnologia Sinica, 2012, 43(5): 943-953 [强俊, 杨弘, 王辉, 等. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响. 海洋与湖沼, 2012, 43(5): 943-953] |
SONG W H, GLADYS L, DONG Y W, et al. The effects of thermal stress on survival and expression of the heat shock protein of grass carp Ctenopharyngodon idellus. Transactions of Oceanology and Limnology, 2012(1): 27-32 [宋文华, Gladys Ludevese, 董云伟, 等. 高温对草鱼热休克蛋白表达的影响. 海洋湖沼通报, 2012(1): 27-32] |
WANG Y, JI L Q, SUN G X, et al. Effects of dietary β-glucan on some growth and blood physiological indices of rainbow trout (Oncorhynchus mykiss). Journal of Economic Animal, 2018, 39(3): 65-71 [王艺, 纪利芹, 孙国祥, 等. 饲料中添加β-葡聚糖对虹鳟部分生长指标和血液生理指标的影响. 渔业科学进展, 2018, 39(3): 65-71] |
WEN H S, LÜ L K, LI L M, et al. Effect of temperature on physiological and biochemical parameters and gene expression of male Sebastes schllegelii. Periodical of Ocean University of China (Natural Science), 2016, 46(11): 44-51 [温海深, 吕里康, 李兰敏, 等. 急性高温胁迫对雄性许氏平鲉血液生理生化及相关基因表达的影响. 中国海洋大学学报(自然科学版), 2016, 46(11): 44-51] |
WEN X. Study on physiological response and molecular mechanism of Takifugu obscurus to low temperature stress. Doctoral Dissertation of Nanjing Normal University, 2019 [文鑫. 暗纹东方鲀(Takifugu fasciatus)应对低温胁迫的生理响应和分子机制研究. 南京师范大学博士研究生学位论文, 2019]
|
XU Y Q, CAO Z W, DING Z K, et al. Effects and prevention of high temperature on fishes. Fisheries Science, 2010, 29(4): 235-242 [许友卿, 曹占旺, 丁兆坤, 等. 高温对鱼类的影响及其预防研究. 水产科学, 2010, 29(4): 235-242] |
XUE J H, ZHANG J G, SHI J H, et al. The comparison of hematological indices of common carp in different ecological environment. Journal of Shanghai Ocean University, 1995, 2(4): 112-117 [薛家华, 张家国, 师吉华, 等. 不同生态环境内鲤的几项血液指标的比较. 上海水产大学学报, 1995, 2(4): 112-117] |
YANG K, HUANG Z H, MA A J, et al. Transcriptome study of kidney of turbot under high-temperature stress. Progress in Fishery Sciences, 2020, 41(1): 86-95 [杨凯, 黄智慧, 马爱军, 等. 高温胁迫条件下大菱鲆肾脏转录组研究. 渔业科学进展, 2020, 41(1): 86-95] |
YOU H Z, HAN T, LIU Y G, et al. Techniques for industrial farming of Oplegnathus punctatus. China Fisheries, 2015(9): 82-84 [尤宏争, 韩天, 刘永鸽, 等. 斑石鲷工厂化养殖技术初探. 中国水产, 2015(9): 82-84] |
YU W, YANG Y K, CHEN Z B, et al. Dietary effect of Spirulina platensis on growth performance, digestive enzymes, hematological indices and antioxidant capacity of Chinese sea bass (Lateolabrax maculatus). South China Fisheries Science, 2019, 15(3): 57-67 [虞为, 杨育凯, 陈智彬, 等. 饲料中添加螺旋藻对花鲈生长性能、消化酶活性、血液学指标及抗氧化能力的影响. 南方水产科学, 2019, 15(3): 57-67] |
ZHANG H X, LI K M, WANG N, et al. Establishment and characterization of a liver cell line from spotted knifejaw (Oplegnathus punctatus). Journal of Agricultural Biotechnology, 2020, 28(2): 360-368 [张宏祥, 李坤明, 王娜, 等. 斑石鲷肝脏细胞系的建立与鉴定. 农业生物技术学报, 2020, 28(2): 360-368] |
ZHANG Y C, WEN H S, LI L M, et al. Effect of acute temperature stress on serum cortisol and hematological physiology of gestated Sebastes schlegelii. Journal of Fisheries of China, 2015, 39(12): 1872-1882 [张亚晨, 温海深, 李兰敏, 等. 急性温度胁迫对妊娠期许氏平鲉血清皮质醇和血液生理指标的影响. 水产学报, 2015, 39(12): 1872-1882] |
ZHOU C W, HU X W, LEI L, et al. Effects of heat stress on biochemical indices and HSP70 mRNA expression in gibel carp (Carassius auratus gibelio). Progress in Fishery Sciences, 2018, 39(6): 65-71 [周朝伟, 胡续雯, 雷骆, 等. 热应激对银鲫生化指标和HSP70 mRNA表达的影响. 渔业科学进展, 2018, 39(6): 65-71] |
ZHOU W B, SHI J G, YU W W, et al. Current situation and development trend of marine seine culture in China. Fishery Information and Strategy, 2018, 33(4): 259-266 [周文博, 石建高, 余雯雯, 等. 中国海水围网养殖的现状与发展趋势探析. 渔业信息与战略, 2018, 33(4): 259-266] |
ZOU G H, SONG W, XIE Z L. Large-scale enclosure culture technology of Larimichthys crocea in the deep sea. China Fisheries, 2021(6): 57-60 [邹国华, 宋炜, 谢正丽. 大黄鱼深远海大型围栏养殖技术. 中国水产, 2021(6): 57-60] |



