2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 山东 青岛 266071;
3. 山东长岛近海渔业资源国家野外科学观测研究站 山东 烟台 265800
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Shandong Provincial Key Laboratory of Fishery Resources and Ecological Environment, Qingdao, Shandong 266071, China;
3. National Field Observation and Research Center for Fisheries Resources in Changdao Waters, Yantai, Shandong 265800, China
生物多样性是人类赖以生存和发展的重要基础,是地球生命共同体的血脉和根基。人类进入工业时代以来,生产力水平不断提高,但同时产生了许多生态环境问题,导致全球生物多样性遭受不同程度的破坏(Metz et al, 2001)。人类造成的全球气候和土地利用变化正日益威胁着从极地到热带、陆地到海洋的生物多样性(Díaz et al, 2020)。其中,海洋生物的多样性可能超过在陆地环境中发现的所有物种(Heip et al, 2003)。近岸岛屿毗邻海域作为最具代表性的海洋区域之一,承载着大量的初级生产力,是许多海洋生物生长、繁殖的栖息地和洄游通道,也是生物多样性的热点区域。然而,近岸岛屿毗邻海域海洋自然资源的日益开发,例如海水养殖、捕捞、航运和能源开发等人类活动,给海洋生物带来了越来越大的压力(Jacob et al, 2020),这些压力造成了海洋生物群落受到不同程度的干扰,生物多样性遭到严峻挑战。
庙岛群岛位于黄渤海的交汇处,由大小32个岛屿组成,生物资源丰富,是最具代表性的北方近岸群岛,也是研究与保护生物多样性的理想区域。该地区为许多生物提供了良好的栖息环境和洄游迁徙通道(隋士凤等, 2000)。岛屿南部靠近山东半岛,是重要的航运通道,且岛屿周边存在大量的贝类养殖区域,海域受人为活动影响较大,具有明显的海–陆相互作用(Chi et al, 2017)。过去,由于人类活动和气候变化的影响,庙岛群岛海域的生物多样性受到了一定影响,但有关该海域底层渔业生物调查较少,随着国家级湿地自然保护区长岛保护区的建立,亟需对该海域开展系统的生物多样性研究,以促进海洋生物多样性的恢复和保护。
本研究为系统掌握庙岛群岛毗邻海域底层渔业生物群落多样性分布特征,于2020年9、11、12月和2021年3―12月(逐月)对庙岛群岛毗邻海域展开了单船阿氏网调查,通过丰富度指数(D)、均匀度指数(J)、生物多样性指数(H´)、冗余分析(redundancy analysis, RDA)和ABC曲线(abundance-biomass comparison curves)对该海域底层渔业生物多样性及其影响因素进行分析,以期为庙岛群岛毗邻海域生物多样性保护提供科学基础,同时,为探究典型岛屿生物多样性形成的内在、环境与人为因素提供基础资料和数据支持。
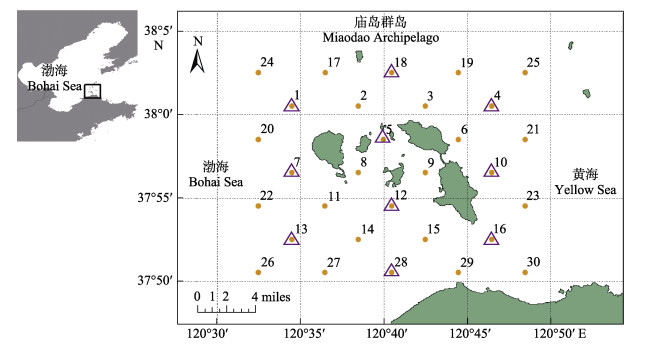
1 材料与方法 1.1 采样站位本研究于2020年9、11、12月和2021年3―12月对庙岛群岛毗邻海域(120.5°~120.8°E, 37.8°~ 38.0°N)展开调查,其中,2020年9、11、12月和2021年3、8月开展了30个站位的航次调查(图 1),其余月份进行了10个站位的航次调查(图 1紫色三角形站位)。
|
图 1 庙岛群岛采样站位 Fig.1 The sampling stations of the waters around Miaodao Archipelago 紫色三角形为部分月份进行的10站位采样站位。 The purple triangle is the sampling station of 10 stations carried out in some months. |
庙岛群岛毗邻海域水深较浅,岛屿周边存在许多养殖区域,且海底情况较为复杂,有很多的碎石与碎贝壳,无法进行长时间的底拖网调查。因此,本研究选取了阿氏网(网架高0.4 m、长2.4 m;网长9 m、网口高2.5 m、网目共380扣,最大网目直径2.54 cm、最小网目直径0.9 cm)进行底层渔业生物采样。调查船只为“鲁昌渔65678”和“鲁昌渔64756”,功率为110 kW,每站拖网时间为10 min,拖速为2.5 kn。环境信息由CTD (美国SeaBird公司)获取,主要获取的环境数据包括水深、表层盐度、底层盐度、表层温度和底层温度。样品在船上采集完成后冷冻保存,带回实验室进行种类鉴定和生物学测量。样品处理、保存、计数、鉴定等均按《海洋调查规范》(GB/T 12763.6- 2007)进行。生物均鉴定至种,统计数量和湿重,分类依照《中国海洋生物名录》(刘瑞玉等, 2008)、《渤海山东海域海洋保护区生物多样性图集》(王茂剑等, 2017)等。
1.3 数据分析 1.3.1 数据标准化根据各站实际拖网时间,进行标准化处理,换算为单位时间生物量(g/10 min)和尾数(ind./10 min)。
1.3.2 优势度利用Pinkas相对重要性指数(index of relative importance, IRI)确定种类在群落中的重要性(Pinkas et al, 1971),其计算公式为:
| $ {\text{IRI}} = (W{\text{% }} + N{\text{% }}) \times F{\text{% }} \times {10^4} $ | (1) |
式中,W%为某种生物的生物量占当月总生物量的百分比,N%为某种生物的数量占当月总数量的百分比,F%为某种生物的出现频率。IRI≥1000的种类为优势种,100≤IRI < 1000为重要种(单秀娟等, 2011)。
1.3.3 群落多样性采用Margalef种类丰富度指数(D)、Shannon-Wiener多样性指数(H´)和Pielou均匀度指数(J´)分析鱼类群落结构多样性(Margalef, 1958; Wilhm, 1968; Pielou, 1975), 其计算公式如下:
Margalef种类丰富度指数:
| $ D = \frac{{S - 1}}{{\ln N}} $ | (2) |
Shannon-Wiener多样性指数:
| $ H\prime = - \sum\limits_{i = 1}^S {\frac{{{N_i}}}{N}} \ln \frac{{{N_i}}}{N} $ | (3) |
Pielou均匀度指数:
| $ J\prime = \frac{{H\prime }}{{\ln S}} $ | (4) |
式中,S为当月物种数量,Ni为当月物种i数量,N为当月所有物种的总数量。
1.3.4 丰度/生物量比较曲线(ABC曲线)ABC曲线用于表征底层渔业生物群落受扰动情况,若生物量曲线在丰度曲线之上,W为正值,代表群落未受扰动,该海域由少量大个体、长生活史物种主导;若生物量曲线与丰度曲线接近或出现部分相交,W接近0,代表生物群落受到中度干扰,该海域由短生活史、高生长率的物种主导;若生物量曲线在丰度曲线之下,W为负值,代表生物群落遭受严重扰动,处于不稳定状态,趋向于由小个体、机会种主导(胡桂坤等, 2019)。W作为ABC曲线方法的统计量(Clarke et al, 2001),其公式为:
| $ W = \mathop \sum \limits_{i = 1}^S \frac{{({B_i} - {A_i})}}{{50(S - 1)}} $ | (5) |
式中,Bi和Ai为ABC曲线中种类序号对应的生物量和数量的累积百分比,S为出现物种数。当生物量优势曲线在数量优势度曲线之上时,W为正,反之W为负。
1.3.5 冗余分析(RDA)选取主要生物类群的标准化丰度和CTD获得的环境数据(深度、表底温度、表底盐度)进行RDA分析。在进行RDA分析前,对物种进行去趋势对应分析(detrended correspondence analysis, DCA)分析,若分析结果4个轴中梯度最大值小于3,则选择RDA分析,若大于4,则选择典范对应分析(canonical correspondence analysis, CCA)分析,若处于3~4之间,则2种分析方法均可。
统计分析和数据可视化使用R 4.1.2、PRIMER6、Cannoco5、Origin 2021进行。
2 结果 2.1 种类组成及优势种调查共捕获底层渔业生物115种,以底栖生物居多,其中,鱼类49种,软体动物29种,甲壳动物28种,棘皮动物8种,腕足动物1种。鱼类主要为白姑鱼(Pennahia argentata)、虾虎鱼类。其中,白姑鱼分布呈现明显季节变化,气温较低的调查月份(2020年11、12月,2021年3、4月)均未出现白姑鱼。软体动物主要为短蛸(Octopus ocellatus)、日本枪乌贼(Loligo japonica)、扁玉螺(Glossaulax didyma)、脉红螺(Rapana venosa)等。甲壳动物主要为口虾蛄(Oratosquilla oratoria)、日本鼓虾(Alpheus japonicus)等。棘皮动物主要有哈氏刻肋海胆(Temnopleurus hardwickii)、海燕(Asterina pectinifera)、马氏刺蛇尾(Ophiothrix marenzelleri)等。腕足动物为酸浆贝(Terebratella coreanica)。综合考虑底层生物的优势度与重要性,本研究将庙岛群岛毗邻海域底层渔业生物群落主要分为以下几个生物类群,分别为白姑鱼、虾虎鱼类、其他鱼类、口虾蛄、日本鼓虾、其他甲壳类、软体动物、棘皮动物和腕足动物(酸浆贝)(图 2和图 3)。不同月份的主要生物组成不同(表 1),其中优势种(IRI≥1000)共有14种,分别为矛尾虾虎鱼(Chaemrichthys stigmatias)、白姑鱼、葛氏长臂虾(Palaemon gravieri)、鹰爪虾(Trachypenaeus curvirostris)、口虾蛄、日本鼓虾、双斑蟳(Charybdis bimaculata)、艾氏活额寄居蟹(Diogenes edwardsii)、短蛸、扁玉螺、脉红螺、哈氏刻肋海胆、海燕、马氏刺蛇尾。

|
图 2 庙岛群岛毗邻海域主要生物类群生物量的季节变化 Fig.2 Seasonal composition and distribution of biomass of main groups in bottom fishery communities in the waters around Miaodao Archipelago A为10站位,B为30站位。弦图上半部分代表月份,下半部分为主要的生物类群,分别为白姑鱼、虾虎鱼类、其他鱼类、口虾蛄、日本鼓虾、其他甲壳类、软体动物、棘皮动物和腕足动物(酸浆贝)。连线代表某种生物类群在该月份所占的生物量。线的颜色与月份颜色一致。 A shows the 10 sampling stations and B shows the 30 sampling stations. The top half of the chord diagram represents the months, and the bottom half represents the major groups of organisms. The groups are Pennahia argentata, Gobiidae, other fishes, Oratosquilla oratoria, Alpheus japonicas, other crustaceans, Mollusk, Echinoderm and Terebratella coreanica. The lines represent the biomass of a particular group of organisms in that month. The color of the line matches the color of the month. |

|
图 3 庙岛群岛毗邻海域主要生物类群丰度的季节变化 Fig.3 Seasonal composition and distribution of abundance of main groups in bottom fishery communities in the waters around Miaodao Archipelago A为10站位,B为30站位。弦图上半部分代表月份,下半部分为主要的生物类群,分别为白姑鱼、虾虎鱼类、其他鱼类、口虾蛄、日本鼓虾、其他甲壳类、软体动物、棘皮动物和腕足动物(酸浆贝)。连线代表某种生物类群在该月份所占的丰度。线的颜色与月份颜色一致。 A shows the 10 sampling stations and B shows the 30 sampling stations. The top half of the chord diagram represents the months, and the bottom half represents the major groups of organisms. The groups are Pennahia argentata, Gobiidae, other fishes, Oratosquilla oratoria, Alpheus japonicas, other crustaceans, Mollusk, Echinoderm and Terebratella coreanica. The lines represent the abundance of a particular group of organisms in that month. The color of the line matches the color of the month. |
|
|
表 1 庙岛群岛毗邻海域主要渔业生物种类的相对重要指数(IRI) Tab.1 The index of relative importance (IRI) of major species in the waters around Miaodao Archipelago |
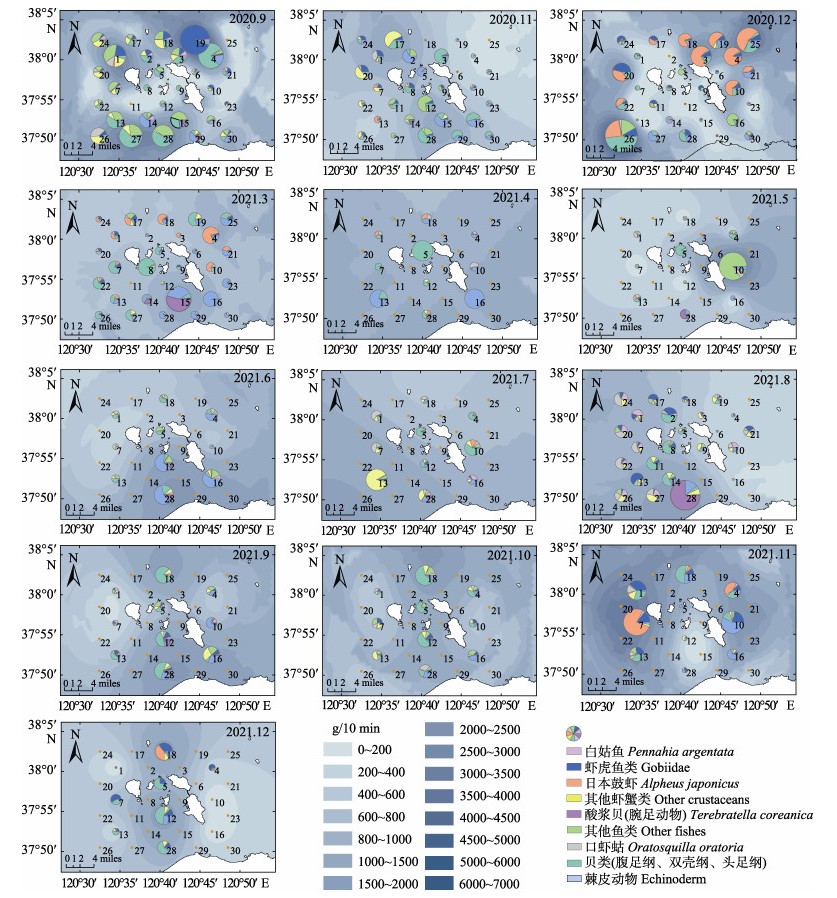
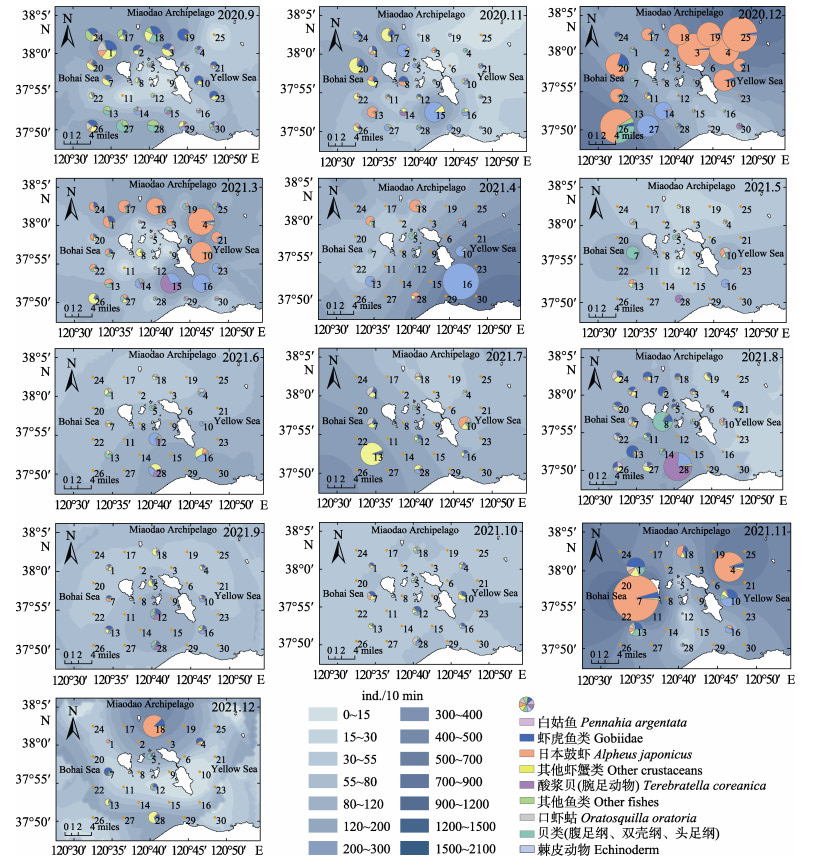
庙岛群岛底层渔业生物资源密度在3―6月主要集中在调查海域东南部,7、8月集中分布于西南部,其余月份没有明显的高资源密度分布区(图 4和图 5)。此外,2020年冬季(11、12月)和2021年冬季(11、12月)均具有较高的资源密度。冬季日本鼓虾、软体动物和棘皮动物为主要生物类群,夏秋季鱼类种类明显增多。
|
图 4 庙岛群岛毗邻海域底层渔业生物种类的资源密度(生物量)空间分布 Fig.4 Species composition and spatial distribution of bottom fishery community biomass in the adjacent sea of Miaodao Archipelago in each month 扇形图的大小代表了生物量的高低,内部颜色代表了组成的主要生物类群。蓝色底图为生物量的普通克里金插值,颜色越深代表生物量越高。 The size of the pie chart represents the height of the biomass, and the color of the interior represents the main groups of organisms. The blue base is a normal Kriging interpolation of biomass, with darker colors representing higher biomass. |
|
图 5 庙岛群岛毗邻海域底层渔业生物种类资源密度(丰度)空间分布 Fig.5 Species composition and spatial distribution of bottom fishery community abundance in the adjacent sea of Miaodao Archipelago in each month 扇形图的大小代表了丰度的高低,内部颜色代表了组成的主要生物类群。蓝色底图为丰度的普通克里金插值,颜色越深代表生物量越高。 The size of the pie chart represents the height of the abundance, and the color of the interior represents the main groups of organisms. The blue base is a normal Kriging interpolation of abundance, with darker colors representing higher biomass. |
庙岛群岛毗邻海域底层渔业生物多样性指数夏秋季较高(表 2)。物种数的变化范围为34~61,其中2021年12月最低,2020年9月最高;个数变化范围为619~8553,其中2021年10月最低,2020年12月最高;丰富度(D)变化范围为4.29~7.53,其中2020年12月最高,2021年10月最低;均匀度指数(J´)变化范围为0.27~0.78,其中2020年12月最低,2021年9月最高;生物多样性指数(H´)变化范围为1.05~3.00,其中2020年12月最低,2020年9月最高。
|
|
表 2 庙岛群岛毗邻海域底层渔业生物多样性指数 Tab.2 Monthly diversity indices of bottom fishery communities in the waters adjacent to Miaodao Archipelago |
对庙岛群岛毗邻海域主要生物类群间进行了Spearman非参数检验(图 6和图 7)。白姑鱼和日本鼓虾在生物量和丰度上均表现出极显著的负相关(生物量: r= –0.75, P < 0.01; 丰度: r= –0.73, P < 0.01)。在白姑鱼生物量和丰度较多的月份,如夏秋季,日本鼓虾的生物量和丰度较低;在白姑鱼消失的冬季,日本鼓虾生物量和丰度突然增多。此外,白姑鱼和其他鱼类(r=0.57)、虾虎鱼类和其他鱼类(r=0.59)、口虾蛄和白姑鱼(r=0.6)、口虾姑和其他鱼类(r=0.62)、口虾蛄和其他甲壳类(r=0.6)、其他鱼类和其他甲壳类(r=0.56)、虾虎鱼类和软体动物(r=0.61)间在丰度上呈现显著的正相关(P < 0.05)。其他甲壳类和白姑鱼(r=0.66)、其他甲壳类和口虾蛄(r=0.6)、虾虎鱼类和软体动物(r=0.64)、白姑鱼和酸浆贝(r=0.57)在生物量上呈现出显著的正相关(P < 0.05)。
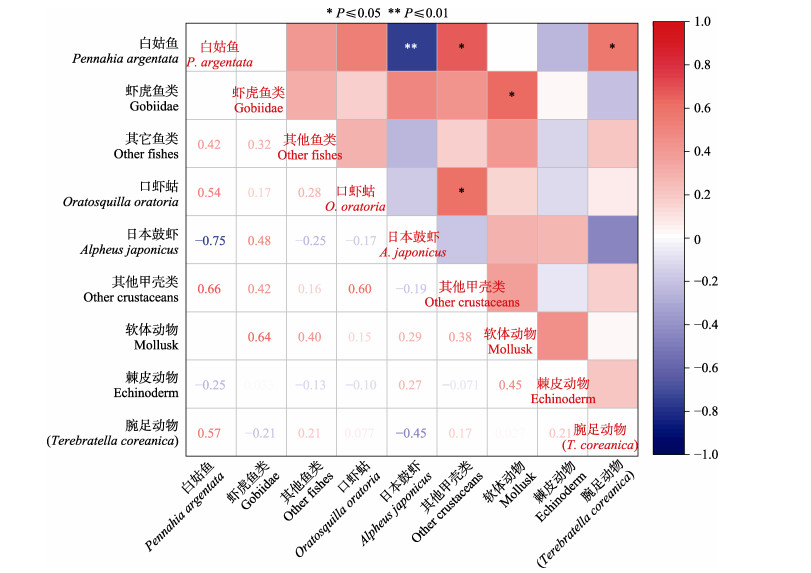
|
图 6 庙岛群岛毗邻海域主要生物类群生物量间的相关性热图 Fig.6 Correlation plot of biomass correlation between main groups of bottom fishery communities in the sea adjacent to the Miaodao Archipelago |
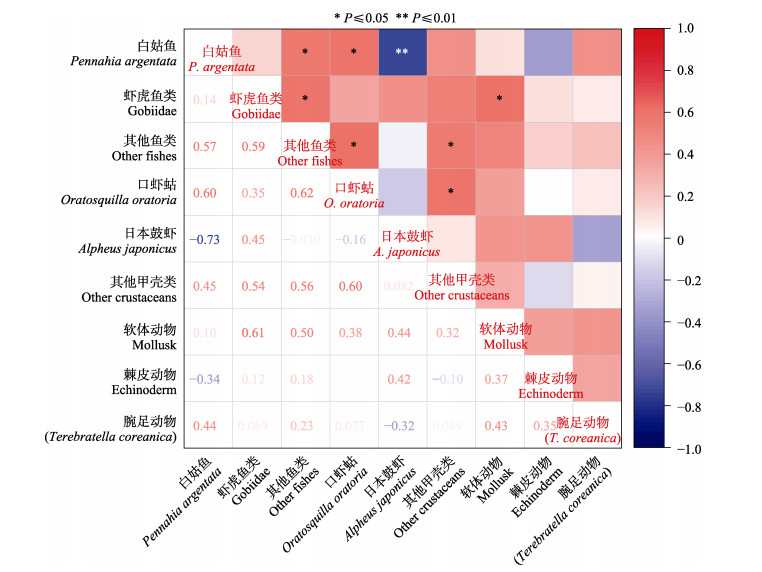
|
图 7 庙岛群岛毗邻海域主要生物类群丰度间的相关性热图 Fig.7 Correlation plot of abundance correlation between main groups of bottom fishery communities in the sea adjacent to the Miaodao Archipelago |
DCA分析结果显示,4个轴中梯度gradient length分别为3.16、2.32、2.84和2.16,最大值介于3和4之间,后续分析采用RDA分析或CCA分析均可。本研究采用RDA对主要生物类群的标准化丰度与主要环境因子间的关系进行分析,以识别显著环境因子及其对主要生物类群丰度的影响。RDA前向选择最终模型中,第一排序轴特征值为0.1,第二排序轴特征值为0.045;2个排序轴共解释物种变异的24.5%,共解释群落组成变异的83.1%;蒙特卡洛置换检验结果显示,第一排序轴P = 0.002,所有排序轴P=0.002,均呈现显著差异(P < 0.05)(图 8)。水深和温度是影响生物类群丰度的主要显著环境因子。其中,棘皮动物和酸浆贝与水深表现为正相关,软体动物和水深表现为负相关;口虾蛄、其他鱼类、其他甲壳类、白姑鱼、虾虎鱼类、软体动物和酸浆贝和温度表现为正相关,与盐度表现为负相关;日本鼓虾和温度表现为负相关;表层盐度和底层盐度、表层水温和底层水温在对主要生物类群丰度的影响上均没有明显的区别。
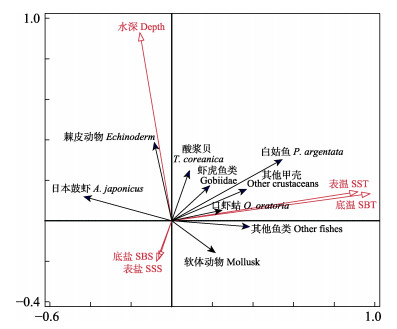
|
图 8 庙岛群岛毗邻海域主要生物类群丰度与主要环境因子间的RDA排序图 Fig.8 RDA ordination of main biota abundance and environmental factors of bottom fishery communities in the sea adjacent to the Miaodao Archipelago 红色箭头代表环境因子,蓝色箭头代表主要的生物类群丰度。 The red arrows represent environmental factors, and the blue arrows represent abundance of major groups of organisms. |
庙岛群岛毗邻海域底层渔业生物ABC曲线W值的范围为–0.138~0.020,2021年11月的W统计值最低,2021年5月的W值最高(图 9)。其中,2020年9月、2020年5月和6月W值为正(分别为0.009、0.020和0.015),且W值接近0,丰度曲线和生物量优势度曲线接近重合并出现交叉,为中等程度干扰。其余月份W值均小于0,丰度曲线位于生物量优势度曲线之上,且W值在–0.138~ –0.077之间,表明遭受强烈的扰动。总体来看,庙岛群岛毗邻海域底层渔业生物群落受到较高干扰,仅在个别月份为中等程度干扰。
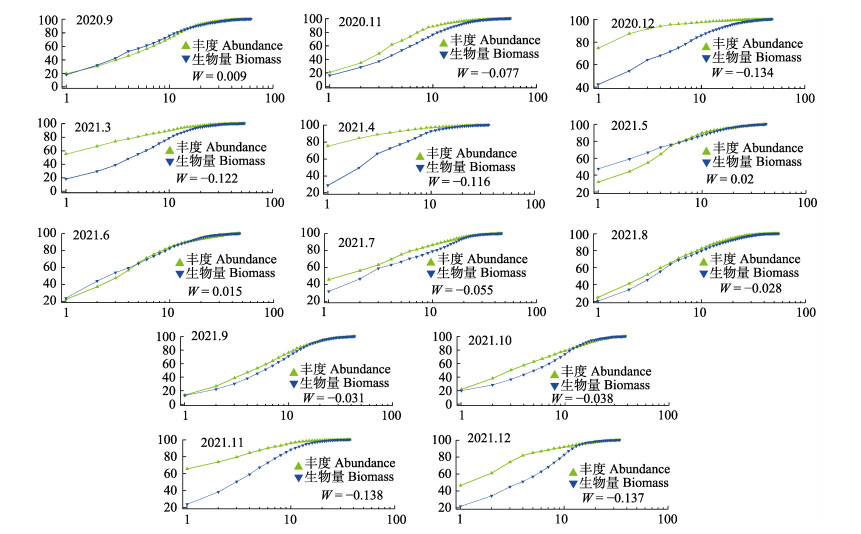
|
图 9 庙岛群岛毗邻海域底层渔业生物的ABC曲线 Fig.9 ABC curve of bottom fishery species in the sea adjacent to the Miaodao Archipelago |
庙岛群岛毗邻海域底层渔业种群整体上以底栖生物为主,包括底栖的软体动物、甲壳动物、棘皮动物等。鱼类也以白姑鱼和矛尾虾虎鱼、六丝矛尾虾虎鱼(Amblychaeturichthys hexanema)等小型底栖岛礁性鱼类为主。这主要是由于庙岛群岛周边海域环境造成的。该区域水深范围为3~35 m,水深较浅,海底多礁石,水流速较快(黄风洪等, 2015),因此,本地种以小型底层鱼类和底层无脊椎动物为主。由于航运、养殖、捕捞等人类活动的影响,该区域的渔业资源呈现出小型化、低龄化的特征(程济生等, 1998; 刘旭东等, 2021)。同时,由于庙岛群岛毗邻水域处于黄渤海的交汇处,是许多鱼类的进出渤海与黄海的洄游通道,这里又存在许多的迁徙种。如白姑鱼在每年的3―4月陆续进入山东半岛的北部沿海,途径庙岛群岛至渤海各海湾产卵,9―11月在渤海中部索饵,形成越冬群体,11月后经过庙岛群岛后绕过成山头向越冬场洄游,12―1月份到达越冬场(徐兆礼等, 2010)。这与在本研究结果相符,白姑鱼在该区域直至4、5月开始陆续出现,至夏末秋初(8―10月)达到生物量的顶峰,11月开始消失。
此外,酸浆贝在部分月份庙岛群岛南部海域呈现出较高的生物量与丰度。酸浆贝是一种原始且古老的腕足动物(柳淑芳等, 2018),在进化上是从原口动物过渡到后口动物的一个中间类型(倪景辉, 1994),主要分布在我国的山东半岛北岸、南岸和辽东半岛南岸,其主要生活在近岸浅海,营固着生活,通常栖息在岩性海岸和有岩石露头的海底,或附着在软体动物贝壳上(王洪法等, 2011)。庙岛群岛南部海域是连接长岛县和山东半岛的主要航运通道,该区域底质具有较多的岩石、岛礁碎石和死亡贝壳,这些石头和贝壳为酸浆贝提供了良好的固着基质,在环境适宜的月份,可能导致了酸浆贝的生物量迅速增加。
3.2 底层渔业生物群落时空分布在时间分布上,庙岛群岛毗邻海域底层渔业生物群落在夏秋季节月份呈现出较高的生物多样性,体现在较高的物种数、丰富度指数、均匀度指数和生物多样性指数上;而在冬春季节呈现出较低的生物多样性但较高的生物量和丰度。这主要可能是由于冬春季节温度较低,许多洄游性鱼类群落从庙岛群岛海域向北黄海越冬洄游(徐兆礼等, 2010),鱼类的减少导致其饵料生物如甲壳类、贝类的被捕食压力减少,从而造成如日本鼓虾这类较为单一物种的高生物量与高丰度。随着春夏季温度的升高,许多洄游性鱼类途径庙岛群岛海域回到渤海(徐兆礼等, 2010),造成了该区域较高的生物多样性。
在空间分布上,庙岛群岛毗邻海域底层渔业生物群落在3―6月主要集中在岛群的东南区域,而到了7、8月则主要集中西南区域。这可能是因为在较寒冷的3、4月,黄海暖流带来的较温暖的海水为底层渔业生物群落提供了更适宜的生存环境,导致较多的生物群落聚集在庙岛群岛东南侧的北黄海海域。北黄海和渤海海峡比渤海内部温度高,存在暖舌,在1月后黄海暖流途径渤海海峡持续向渤海流动(于华明等, 2020)。到5、6月,许多洄游海洋生物陆续途径北黄海游至渤海海峡,可能造成岛群东南区域的高生物量。而到7、8月,许多洄游生物已经到达莱州湾海域,并且随着夏季莱州湾沿岸浮游植物的增多,较多的浮游生物吸引来了许多消费者群落(韩青鹏等, 2022; 由丽萍等, 2021)。此外,每年6―7月进行的黄河调水调沙可能造成大流量的淡水和营养盐引入庙岛群岛西南侧海域,从而导致在该区域夏季较高的生物量(徐华等, 2021)。
3.3 底层渔业生物群落多样性及其影响因素通过对庙岛群岛主要生物类群间的相关性分析发现,白姑鱼和日本鼓虾在生物量和丰度上都具有极显著的负相关(P<0.01)。在白姑鱼高生物量和高丰度月份,日本鼓虾生物量与丰度均维持在较低水平;而到了白姑鱼洄游离开庙岛群岛海域的11月,日本鼓虾呈现出暴发式的增长。本研究对白姑鱼的胃含物进行了分析,发现日本鼓虾是白姑鱼的主要饵料生物。相关研究也表明,白姑鱼5―11月出现于渤海,主要摄食底栖虾类(以日本鼓虾、鲜明鼓虾为主),其次为鱼类(以虾虎鱼为主)(邓景耀等, 1986; 易晓英, 2021; 张波, 2018)。庙岛群岛海域日本鼓虾生物量与丰度可能在一定程度上取决于其捕食者白姑鱼的数量。其他存在显著正相关的种类可能是共同受环境因子如温度的影响。
RDA冗余分析表明,水深和温度是影响庙岛群岛毗邻海域底层渔业群落结构的主要环境因子。庙岛群岛海域水深分布如图 10所示,岛群周边海域水深变化较大,从3 m到35 m不等,30 m以上的深水区主要集中在岛群北部和29站位附近,10 m以下的浅水区主要集中在岛群内部5、8、9、12站位所在区域。浅水区的底层渔业群落生物量和丰度均较低(图 4和图 5)。这可能是由于岛群内部区域人类活动频繁,如航道、养殖、捕捞等活动,并且浅水受风浪扰动较大,底层环境易受干扰且不稳定造成的。棘皮动物、酸浆贝与水深呈明显的正相关,海水越深,棘皮动物和酸浆贝的生物量和丰度越大。这可能是因为棘皮动物和酸浆贝主要是底栖或营固着生活的种类,深水区相比岛群内部的潜水区域海底环境更稳定,不易受到干扰(Bergen et al, 2001)。其余大部分生物类群与水温呈明显的正相关。庙岛群岛海域属于暖温带季风区大陆性气候,一年四季分明,光照和降雨充足(隋士凤等, 2000),温度变化范围较大,海水温度从冬季的3.71℃到夏季的26.00℃,变化范围为22.29℃。由于该区域存在许多洄游种类,季节和温度导致不同时期底层渔业生物群落结构具有较大的区别。而相比水深和温度,盐度对底层渔业生物群落结构的影响较小,主要是因为该区域地理面积较小,盐度的区域和季节变化不明显,仅在2021年冬季出现了较低的盐度。而大部分种类与盐度表现出一定程度的负相关。
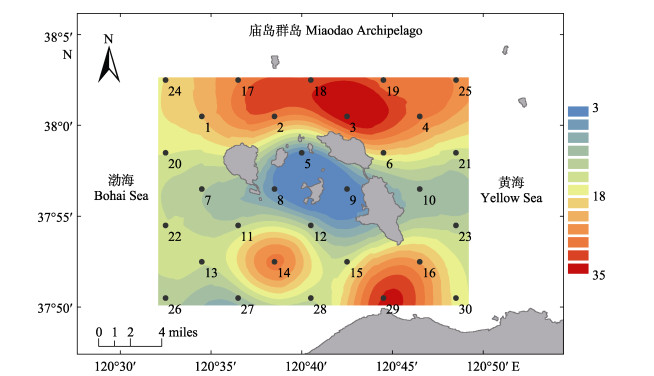
|
图 10 庙岛群岛毗邻海域水深插值图(普通克里金插值法) Fig.10 Water depth interpolation map of the sea adjacent to the Miaodao Archipelago (ordinary Kriging interpolation method) |
在稳定的渔业群落中,其生物量主要以较大个体为主,种类组成以较长生命周期的物种为主;随着干扰的加剧,渔业生物群落发生结构的转变,转向小个体、生长迅速的种类,出现小型化和低龄化的现象(Svedäng et al, 2003; 李圣法, 2008)。庙岛群岛毗邻海域ABC曲线虽然各有不同,但大部分W统计值为负,仅有3个月的W统计值为正(接近于0)。根究Clarke等(2001)的划分标准,庙岛群岛毗邻海域底层渔业群落处于相对比较严重的干扰状态,但某些季节呈现有所好转的状态,这主要与鱼类群落中各种类的补充、生长等内在因素及人为因素(如捕捞)有关。如2021年5月和6月的W统计值均为正,从5月开始实施伏季休渔措施后,庙岛群岛海域的受干扰程度有所降低。伏季休渔期有效保护了渔业种类的仔稚鱼,并大大减少了其他兼捕物的捕捞,为渔业资源的恢复提供了有效的保障(胡芷君等, 2020)。另外,每年4―5月,许多洄游种类开始陆续通过庙岛群岛海域向渤海洄游,这为该海域渔业生物种类增加提供了条件。但是,由于庙岛群岛海域存在大面积的人工养殖区域,以及来往于各个岛屿间的船只的影响,该海域整体呈现出较大干扰程度,处于不稳定的状态。
4 结论庙岛群岛毗邻海域的底层渔业生物群落以虾虎鱼类、日本鼓虾、棘皮动物和软体动物为主要的生物类群,受洄游种类的影响,夏秋季节表现出较高的生物多样性,冬春季节生物种类较少但单一种生物量较大;日本鼓虾作为白姑鱼的主要饵料生物,与白姑鱼在生物量和丰度上表现出极显著的负相关;底层渔业生物群落结构主要受到水深和季节因素的影响,庙岛群岛毗邻海域底层渔业生物群落整体处于较为严重的干扰状态;可为庙岛群岛毗邻海域生物多样性保护提供科学基础,同时,为探究典型岛屿生物多样性形成的内在、环境与人为因素提供基础资料和数据支持,但典型岛屿生态系统生物多样性的形成与演化机制尚需进行长时间序列深入研究。
BERGEN M, WEISBERG S, SMITH R, et al. Relationship between depth, sediment, latitude, and the structure of benthic infaunal assemblages on the mainland shelf of southern California. Marine Biology, 2001, 138: 637-647 DOI:10.1007/s002270000469 |
CHENG J S, GUO X W. Distribution and dynamic variations of species and quantity of benthos in the Bohai Sea. Marine Fisheries Research, 1998(1): 31-42 [程济生, 郭学武. 渤海底栖生物的种类、数量分布及其动态变化. 海洋水产研究, 1998(1): 31-42] |
CHI Y, SHI H H, WANG Y Y, et al. Evaluation on island ecological vulnerability and its spatial heterogeneity. Marine Pollution Bulletin, 2017, 125: 216-241 DOI:10.1016/j.marpolbul.2017.08.028 |
CLARKE K R, WARWICK R M. Change in marine communities: An approach to statistical analysis and interpretation. 2nd ed. Primper-E: Plymouth, 2001
|
DENG J Y, MENG T X, REN S M. Food web of fishes in Bohai Sea. Acta Ecologica Sinica, 1986(4): 356-364 [邓景耀, 孟田湘, 任胜民. 渤海鱼类食物关系的初步研究. 生态学报, 1986(4): 356-364] |
DÍAZ S, SETTELE J, BRONDÍZIO E, et al. Summary for policymakers of the global assessment report on biodiversity and ecosystem services of the Intergovernmental Science. Policy Platform on Biodiversity and Ecosystem Services, 2020
|
HAN Q P, SHAN X J, CHEN Y L, et al. Health assessment system of the spawning ground in Shandong inshore waters. Journal of Fishery Sciences of China, 2022, 29(1): 79-90 [韩青鹏, 单秀娟, 陈云龙, 等. 山东近海产卵场健康状况评价体系. 中国水产科学, 2022, 29(1): 79-90] |
HEIP C. "What structures Marine biodiversity and why does it vary?" in Marine Science Frontiers for Europe, eds WEFER G, LAMY F, MANTOURA F (Berlin; Heidelberg: Springer), 2003, 251–264
|
HU G K, QIN L L, LI Y Y, et al. Disturbance status of intertidal macrobenthos in Tianjin based on ABC curves. Journal of Tianjin University of Science and Technology, 2019, 34(5): 57-62 [胡桂坤, 秦璐璐, 李郁郁, 等. 基于ABC曲线的天津潮间带生物群落受扰动的分析. 天津科技大学学报, 2019, 34(5): 57-62] |
HU Z J, SHAN X J, YANG T, et al. Preliminary evaluation of summer fishing moratorium in the Bohai Sea. Progress in Fishery Sciences, 2020, 41(5): 13-21 [胡芷君, 单秀娟, 杨涛, 等. 渤海伏季休渔效果初步评价. 渔业科学进展, 2020, 41(5): 13-21] |
HUANG F H, WANG Y Y, LI J, et al. Phytoplankton community structure and the relationship to environment in southern waters of Miaodao Archipelago in winter in 2013. Journal of Waterway and Harbor, 2015, 36(3): 258-263 [黄风洪, 王媛媛, 李捷, 等. 冬季庙岛群岛南部海域浮游植物群落结构及其与环境因子的关系. 水道港口, 2015, 36(3): 258-263 DOI:10.3969/j.issn.1005-8443.2015.03.020] |
JACOB C, BOCHOVE J-W, LIVINGSTONE S, et al. Marine biodiversity offsets: Pragmatic approaches toward better conservation outcomes. Conservation Letters, 2020, DOI: 10.1111/conl.12711
|
LI S F. Status of fish community in East China Sea using the method of abundance biomass comparison (ABC) curve. Journal of Fishery Sciences of China, 2008, 15(1): 136-144 [李圣法. 以数量生物量比较曲线评价东海鱼类群落的状况. 中国水产科学, 2008, 15(1): 136-144] |
LIU R Y. Checklist of marine biota of China Seas. Beijing: Science Press, 2008: 903-1066 [刘瑞玉. 中国海洋生物名录. 北京: 科学出版社, 2008: 903-1066]
|
LIU S F, LIU Y X, YE N H, et al. DNA barcoding: A potential tool for fishery biodiversity conservation. Journal of Fishery Sciences of China, 2018, 25(4): 902-914 [柳淑芳, 刘永新, 叶乃好, 等. DNA条形码在渔业生物多样性保护中的应用. 中国水产科学, 2018, 25(4): 902-914] |
LIU X D, WANG J S, SUN L E, et al. Community structure and diversity of macrozoobenthos at Bohai Sea off Shandong. Marine Environmental Science, 2021, 40(6): 929–936, 946 [刘旭东, 汪进生, 孙立娥, 等. 渤海山东近岸海域大型底栖动物的群落结构及多样性分析. 海洋环境科学, 2021, 40(6): 929–936, 946] |
MARGALEF R. Information theory in ecology. Gen System, 1958(3): 36-71 |
METZ B, DAVIDSON O, SWART R, et al. Climate change 2001: Mitigation, contribution of working group Ⅲ to the third assessment report of the Intergovernmental Panel on Climate Change. Cambridge, UK: Cambridge University Press, 2001
|
NI J H. They are not shellfish. Sea World, 1994(1): 16 [倪景辉. 它们不属贝类的动物. 海洋世界, 1994(1): 16] |
PIELOU E C. Ecological diversity. New York: Wiley, 1975: 4-49
|
PINKAS L, OLIPHAMT M S, IVERSON I L K. Food habits of albacore, bluefin tuna, and bonito in California waters. California Department of Fish and Gamefish Bulletin, 1971, 152: 1-105 |
SHAN X J, JIN X S. Diversity of fish community structure in the spring-time offshore waters at the Yangtze River estuary. Oceanologia et Limnologia Sinica, 2011, 42(1): 32-40 [单秀娟, 金显仕. 长江口近海春季鱼类群落结构的多样性研究. 海洋与湖沼, 2011, 42(1): 32-40] |
SUI S F, CAI D W. Status and protection of bird resources in Changdao Nature Reserve. Sichuan Journal of Zoology, 2000(4): 247-248 [隋士凤, 蔡德万. 长岛自然保护区鸟类资源现状及保护. 四川动物, 2000(4): 247-248] |
SVEDÄNG H. The inshore demersal fish community on the Swedish Skagerrak coast, regulation by recruitment from offshore sources. ICES Journal of Marine Science, 2003, 60: 23-31 |
WANG H F, LI X Z, WANG J B. Macrobenthic composition and its changes in the Jiaozhou Bay during 2000—2009. Oceanologia et Limnologia Sinica, 2011, 42(5): 738-752 [王洪法, 李新正, 王金宝. 2000—2009年胶州湾大型底栖动物的种类组成及变化. 海洋与湖沼, 2011, 42(5): 738-752] |
WANG M J, SONG X K. Atlas of biodiversity in marine protected areas of Bohai and Shandong seas. Beijing: Marine Press, 2017 [王茂剑, 宋秀凯. 渤海山东海域海洋保护区生物多样性图集. 北京: 海洋出版社, 2017]
|
WILHM J L. Use of biomass units in Shannon's formula. Ecology, 1968, 49: 153-156 |
XU H, WANG B, ZHANG C, et al. Species composition and community structure of ichthyoplankton in coastal waters of Huanghe estuary. Marine Sciences, 2021, 45(11): 105-117 [徐华, 王斌, 张聪, 等. 黄河口近岸海域鱼卵、仔稚鱼种类组成及群落结构特征. 海洋科学, 2021, 45(11): 105-117] |
XU Z L, CHEN J J. Analysis to population division and migratory routine of populations and migratory routines of Argyrosomus argentatus in the north China waters. Acta Ecologica Sinica, 2010, 30(23): 6442-6450 [徐兆礼, 陈佳杰. 依据大规模捕捞统计资料分析东黄渤海白姑鱼种群划分和洄游路线. 生态学报, 2010, 30(23): 6442-6450] |
YI X Y. Feeding ecology of Pawak croaker (Pennahia pawak) in the Beibu Gulf. Masterxs Thesis of Guangdong Ocean University, 2021 [易晓英. 北部湾斑鳍白姑鱼摄食生态研究. 广东海洋大学硕士研究生学位论文, 2021]
|
YOU L P, ZHAO Y T, SUN S, et al. Characteristics of nutrient structures and limitations in Laizhou Bay in the spring and summer of 2018. Progress in Fishery Sciences, 2021, 42(6): 15-24 [由丽萍, 赵玉庭, 孙珊, 等. 2018年春季和夏季莱州湾营养盐结构及限制特征. 渔业科学进展, 2021, 42(6): 15-24] |
YU H M, LI J, YU H Q, et al. Analysis of the interannual variation of the SST in the Yellow Sea warm current area. Marine Forecasts, 2020, 37(5): 34-41 [于华明, 李冀, 于海庆, 等. 黄海暖流区SST年际变化分析. 海洋预报, 2020, 37(5): 34-41] |
ZHANG B. Feeding ecology of fishes in the Bohai Sea. Progress in Fishery Sciences, 2018, 39(3): 11-22 [张波. 渤海鱼类的食物关系. 渔业科学进展, 2018, 39(3): 11-22] |




 Callionymus beniteguri
Callionymus beniteguri