2. 山东省海洋资源与环境研究院山东省海洋生态修复重点实验室 山东 烟台 264006
2. Key Laboratory of Marine Ecological Restoration, Shandong Marine Resource and Environment Research Institute, Yantai 264006, China
海藻具有非常重要的经济、营养、药用和生态价值。全球可供人类使用的海藻共有291种(Balbas et al, 2015),主要用于生产食品和水凝胶,提取药物、糖、有机材料,生产肥料和动物饲料等。海带是一种常见的海产品,属海藻中的褐藻,具有成本低、产量高、营养丰富等优点。海带由于产量大并富含糖类、矿物质、维生素、游离氨基酸、脂肪酸等(孙永泰, 2015),不仅在自然海域中作为刺参的天然饵料,也常被用来作为刺参配合饲料中的主要原料。但海带中含有纤维素、半纤维素、β-葡聚糖、果胶等非淀粉多糖(non-starch polysaccharides, NSP),难以被动物分泌的内源酶降解,并且其中可溶性非淀粉多糖(soluble non-starch polysaccharides, SNSP)具有较强的抗营养作用,溶于水后产生较强的粘性,导致食糜黏度增加、营养屏障作用和微生物菌群数量增加等不利影响,以至于降低养殖动物对饲料养分的消化利用率(Bedford et al, 1992)。因此,将海带的多糖成分进行降解处理是提高其利用率,减少不利影响的有效途径。目前,对海带多糖的降解方法研究较多,如物理降解法、化学降解法和生物降解法。与物理降解法和化学降解法相比,生物降解法具有反应条件温和,专一性强等优势(董学前等, 2017; 姚骏等, 2018)。生物降解法即酶解,是用专一性糖苷酶或非专一性酶通过特异性裂解多糖中的某一糖苷键对多糖进行酶解(郭娜等, 2019),将其分解为更容易吸收的小分子营养物质,降低食糜黏度,提高饲料利用率,进而提高养殖动物的生长性能(曹新勇, 2013; 王亚妮, 2013; 关莹等, 2021)。
刺参(Apostichopus japonicus Selenka)又称仿刺参,被列为“海八珍”之一,具有较高的食用及药用价值,是我国黄渤海海域重要的海水养殖品种(张德瑞等, 2016)。刺参养殖业的大规模发展,为刺参饲料加工业创造了巨大的发展空间,同时也加大了对海藻的需求量。海带作为刺参饲料的主要原料,不仅提供丰富的碳水化合物,而且也是蛋白的主要来源,但海带中含有的非淀粉多糖等成分,在一定程度上限制了其应用效果。本研究在前期预实验和参考前人研究的基础上(王昌义等, 2012; 付燕红等, 2019),采用NSP酶、纤维素酶、中性蛋白酶和风味酶对海带粉进行复合酶解,将海带降解为不同聚合程度的寡糖及肽类,并通过在刺参幼参饲料中添加酶解海带粉(enzymatically hydrolyzed kelp power, EKP)研究其对幼参的生长、体组成、消化和代谢酶活力以及抗氧化能力的影响,为EKP在刺参幼参配合饲料的应用提供理论基础。
1 材料与方法 1.1 酶解海带粉制备实验用酶制剂购于武汉新华扬生物科技有限公司,包括NSP酶(木聚糖酶,8 000 U/g;β-葡聚糖酶, 2 000 U/g;β-甘露聚糖酶,150 U/g)、纤维素酶(500 U/g)、中性蛋白酶(100 000 U/g)、风味酶(5 000 U/g)。酶解海带粉是由海带粉经复合酶制剂(NSP酶∶纤维素酶∶中性蛋白酶∶风味酶=8∶12∶3∶1)水解制成,复合酶添加量3% (占料重),料液比为1∶6,酶解条件:温度50 ℃、pH 6、反应时间6 h。所用海带粉及其酶解产物营养组成见表 1。
|
|
表 1 海带粉和酶解海带粉营养组成及还原糖含量(干物质基础) Tab.1 Nutritional composition and reducing sugar content of kelp powder and enzymatic kelp powder (dry matter basis) |
本研究以鱼粉、海带粉和EKP为主要蛋白源,配制粗蛋白含量为12.00%、粗脂肪含量为0.40%、能量为6.20 KJ/g的基础饲料,其配方及营养组成见表 2和表 3。在基础饲料中分别添加0、3%、6%、9%、12%和15% EKP,命名为D1(对照组)、D2、D3、D4、D5和D6组,各组均添加同等含量的0.6%牛磺酸以解决海带粉中牛磺酸不足的问题(Zhao et al, 2017),配成6组等氮等能的实验饲料。D1~D6添加组中牛磺酸的实际含量分别为0.71%、0.72%、0.69%、0.70%、0.68%和0.69%,各组实验饲料添加0.1%氧化钇(Y2O3)作为外源指示剂。饲料原料经粉碎后过60目筛,混合,制成粒径为6 mm的颗粒。以上各组实验饲料经70 ℃烘干后于–20 ℃冰柜中保存备用。
|
|
表 2 饲料配方及营养组成(%风干物质基础) Tab.2 Proximate composition and ingredients of the experimental diets (% air-dry weight basis) |
|
|
表 3 实验饲料氨基酸组成(%干物质) Tab.3 Amino acids composition of experimental diets (% dry matter) |
实验用刺参购买于山东安源种业科技有限公司(蓬莱)。饲喂实验在山东省海洋资源与环境研究院东营实验基地循环水养殖系统中进行。所有刺参均饲喂基础饲料1周,以适应实验饲料和饲养条件。实验开始前禁食24 h。选择初始平均体重为(11.4±0.04) g的健康刺参540头,随机分配到18个圆柱形循环水桶(Φ 65 cm×60 cm),分为6个实验组,每组3个重复,每个重复30头刺参,饲喂期56 d。每天固定时间(16:00)投饵1次,饱食投喂。每3 d换一次水,并采用虹吸法将残饵和粪便用虹吸软管从桶底吸出,换水量为桶内水位的1/2。养殖实验进行1个月时,彻底清洗水桶。养殖期间水温为13~17 ℃,pH为7.5~8.2,溶解氧不低于6 mg/L,盐度维持在28~30。
1.4 样品采集养殖实验期间,每天投喂前将包膜完整的长条状粪便收集起来,–20 ℃保存,用于后续营养物质表观消化率测定。养殖实验结束时,禁食24 h后,分别对每个养殖桶中的刺参称重并计数。称重后,从每个桶中随机取14头刺参,进行解剖,称量体壁重、内脏重和肠重,将刺参的体壁和肠道,保存在–80 ℃,其中体壁用于后续体成分测定,肠道用于后续酶活测定。
1.5 指标测定 1.5.1 生长性能测定成活率(survival rate, SR, %)=100×Nt/N0
增重率(weight gain rate, WGR, %)=100×(Wt−W0)/W0
特定生长率(specific growth rate, SGR, %/d)= 100×(lnWt−lnW0)/t
脏壁比(viscera-body wall ratio, VBR, %)=100× Wv/Ww
肠壁比(intestine-body wall ratio, IBR, %)=100× Wi/Ww
式中,Nt为刺参终末头数,N0为刺参初始头数,Wt为刺参终末体质量(final body weight, FBW)(g),W0为刺参初始体质量(initial body weight, IBW)(g),t为养殖实验天数(d),Wv为取样刺参内脏质量(g),Wi为取样刺参肠道质量(g),Ww为取样刺参体壁质量(g)。
饲料干物质、营养成分的表观消化率计算公式如下:
饲料干物质表观消化率(%)=100×(1–饲料中Y2O3含量/粪便中Y2O3含量)
饲料营养成分表观消化率(%)=100×[1–(饲料中Y2O3含量/粪便中Y2O3含量)×(粪便中营养成分含量/饲料中营养成分含量)]
1.5.2 饲料、粪便和体壁营养成分测定实验饲料、粪便及刺参体壁水分含量采用105 ℃恒重法测定(GB/T 6435-2014),粗蛋白含量采用凯氏定氮法测定(GB/T 6432-2018),粗脂肪含量采用索氏抽提法测定(GB/T 6433-2006),粗灰分含量采用50 ℃马弗炉灼烧法测定(GB/T6438-2007),氨基酸含量采用酸水解法(GB/T18246-2019)使用全自动氨基酸测定仪(日立L-8900, 日本)测定。饲料和粪便中总磷含量采用分光光度法(GB/T 6437-2018)测定,钇含量采用高频电感耦合等离子体发射光谱法测定,能量采用燃烧法使用量热仪(IKA, C6000, 德国)测定。海带粉和EKP中还原糖的测定(王莉丽等, 2020; 程柳等, 2016),通过3,5-二硝基水杨酸比色(DNS)法,以葡萄糖为标准品,DNS的用量为3 mL,取样品溶液2 mL于25 mL具塞刻度试管中,沸水浴加热6 min,冷却后,于540 nm波长条件下测定还原糖含量。
1.5.3 肠道消化和代谢酶测定肠道中淀粉酶(amylase)、脂肪酶(lipase)、蛋白酶(protease)、ATP酶(adenosine triphosphate)、Na+-K+-ATP酶(Na+-K+-ATPase)、Ca2+-Mg2+-ATP酶(Ca2+-Mg2+-ATPase)、葡萄糖激酶(glucokinase, GK)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate, PEPCK)、谷草转氨酶(asparate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)活性均使用南京建成生物工程研究所生产的试剂盒进行测定,各种酶活性单位参照试剂盒说明书表示。
1.5.4 肠道抗氧化指标测定肠道中过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)活性、总抗氧化能力(total antioxidant capacity, T-AOC)以及丙二醛(malondialdehyde, MDA)含量均使用南京建成生物工程研究所生产的试剂盒进行测定,各种酶活性单位参照试剂盒说明书表示。
1.6 数据统计分析实验数据采用SPSS 17.0进行单因素方差分析(one-way ANOVA)。当达到差异显著(P < 0.05),应用Duncan′s检验进行多重比较分析。统计结果以平均值±标准差(Mean±SD, n=3)的形式表示。
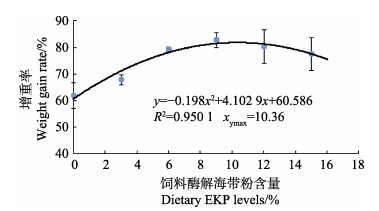
2 结果 2.1 刺参幼参生长性能如表 4所示,随着饲料中EKP含量的增加,FBW、WGR和SGR均呈现先升高后略有降低的趋势,D3、D4、D5和D6组显著高于对照组(P < 0.05);各组间IBR、VBR和SR均无显著性差异(P > 0.05)。以WGR为评价指标,经一元二次回归分析(y=–0.198x2+ 4.102 9x+60.586)得出,EKP在初始质量为(11.40±0.04) g刺参幼参饲料中的最适添加量为10.36% (图 1)。
|
|
表 4 刺参生长性能 Tab.4 Growth performance of sea cucumber A. japonicus |
|
图 1 刺参增重率与饲料中酶解海带粉添加量的回归分析 Fig.1 Regression analysis between dietary enzymatically hydrolyzed kelp power level and weight gain rate of A. japonicus |
如表 5所示,刺参幼参对添加不同水平EKP饲料的干物质的表观消化率无显著差异(P > 0.05);D5和D6组粗蛋白表观消化率显著低于对照组(P < 0.05);总磷的表观消化率呈先上升后下降的趋势,在D3组达到最大值(P < 0.05);所有的EKP添加组均提高了总能表观消化率(P < 0.05);随着EKP含量的升高,饲料中异亮氨酸、亮氨酸、精氨酸和酪氨酸的表观消化率呈先升高后下降的趋势,D6组中异亮氨酸、亮氨酸、组氨酸、精氨酸和酪氨酸的表观消化率显著低于对照组(P < 0.05)。
|
|
表 5 营养素的表观消化率 Tab.5 Apparent digestibility of nutrients |
如表 6所示,饲料中添加EKP并未改变刺参幼参体壁的水分、粗蛋白、粗脂肪和粗灰分含量(P > 0.05)。随着饲料中EKP含量的增加,幼参体壁蛋氨酸含量呈先上升后下降的趋势,D2、D3、D4和D5组显著高于对照组(P < 0.05);半胱氨酸含量呈先上升后平稳趋势,各实验组均显著高于对照组(P < 0.05)。
|
|
表 6 刺参体壁营养组成及氨基酸组成(%干物质) Tab.6 Proximate composition and amino acid composition of body wall of sea cucumber A. japonicus (% dry matter) |
如表 7所示,随着饲料中EKP含量的增加,刺参幼参肠道淀粉酶和蛋白酶活性呈先上升后下降的趋势,且均在D5组达最大值;各组间肠道脂肪酶活性无显著性差异(P > 0.05)。
|
|
表 7 刺参肠道的消化与代谢酶活性 Tab.7 Activities of intestinal digestive and metabolic enzymes of sea cucumber A. japonicus |
葡萄糖激酶(GK)、丙酮酸激酶(PK)和磷酸烯醇式丙酮酸羧激酶(PEPCK)活性均呈先上升后下降的趋势,GK和PEPCK活性D2、D3和D4组显著高于对照组(P < 0.05);Na+-K+-ATPase活性D6组显著高于其他各组(P < 0.05);Ca2+-Mg2+-ATPase活性随EKP添加水平的提高,呈上升趋势,D3、D4、D5和D6组显著高于对照组(P < 0.05)。随饲料EKP含量从0升高到15%,谷草转氨酶(AST)和谷丙转氨酶(ALT)活性呈先升高后下降的趋势,AST和ALT活性均在D5组达到最高值。
2.5 刺参抗氧化性能如表 8所示,肠道总抗氧化能力(T-AOC)和超氧化物歧化酶(SOD)活性随着EKP含量的增加,均呈先升高后下降的趋势,其活性分别在D4组和D5组最高;肠道丙二醛(MDA)含量则呈现与SOD相反趋势,D5组和D6组MDA含量显著高于其他组(P < 0.05);各组间过氧化氢酶(CAT)活性无明显差异(P > 0.05)。
|
|
表 8 刺参肠道抗氧化性能 Tab.8 Intestinal oxidation resistance of sea cucumber A.japonicus |
本研究中,饲料中添加EKP影响幼参的生长性能。随EKP含量的逐渐升高,生长呈先升高后平稳的趋势,是因为海带经NSP酶、纤维素酶、中性蛋白酶和风味酶复合酶制剂酶解后还原糖和酸溶蛋白含量分别提高了96.88%和1.89% (表 1)。饲料中还原糖和可溶性蛋白含量的显著提高,有助于刺参幼参的消化和吸收,并且,其中的糖类和小肽能调节机体代谢,进而提高幼参的生长性能(江晓路等, 2009; Song et al, 2016)。有相关研究已经报道了藻类经酶解处理后能更好的促进海洋动物的生长。如秦搏等(2015)研究发现,用纤维素酶和蛋白酶对浒苔(Enteromorpha prolifera)进行酶解后干燥粉碎处理的饲料可以显著提高刺参的SGR;彭素晓(2017)研究表明,海带酶解产物可显著提高凡纳滨对虾(Litopenaeus vannamei)的SGR,并能显著降低饲料系数,提高非特异性免疫力。本研究结合表观消化率对生长进行分析发现,饲料的粗蛋白、磷和总能的表观消化率和增重率特定生长率呈一致的趋势,说明EKP提高了刺参对饲料营养素的整体利用效率,从而促进了刺参快速生长。但本研究也发现,幼参的生长性能并不随着EKP的添加而进一步提高。相反,EKP添加比例超过9%导致幼参生长率出现下降的趋势,说明添加9%的EKP可能已经超过幼参机体对其代谢处理能力范围,反而对幼参生长代谢产生抑制作用。李猛等(2015)研究表明,饲料中添加过高比例的发酵浒苔会降低刺参幼参的增重率和特定生长率,原因是过量的发酵浒苔释放的葡萄糖和氨基酸等小分子物质含量可能超过了刺参幼参正常的吸收值,从而导致其生长下降。本研究结果显示,当EKP添加量达到12%~15%时,粗蛋白的表观消化率与对照组相比显著降低,说明还原糖含量超过机体耐受极限,并影响肠道对营养物质的吸收,也导致了幼参摄入的总能量呈现降低的现象,导致幼参生长速度减慢,这也解释了过量添加EKP降低幼参生长性能的原因。氨基酸的组成和表观消化率是决定饲料中的蛋白质质量的重要因素(王建学等, 2021)。本研究中,Met、Ile、Leu、His、Arg和Tyr的表观消化率均有显著变化,其中,Ile、Leu、Arg和Tyr含量随着EKP含量的升高呈先升高后下降的趋势,Ile、Leu、Arg含量均在EKP添加量为3%组达到最大,说明低EKP添加提高了幼参对以上4种氨基酸的吸收效率,从而导致氨基酸之间消化的差异性。
本研究表明,随着饲料中EKP含量的增加,各组之间体壁水分、粗蛋白、粗脂肪、粗灰分含量均无显著影响,说明添加EKP并不影响各营养素在幼参体壁的沉积保留。已知组织中氨基酸水平受到饲料中蛋白质质量的影响(Takeshi et al, 2000),从氨基酸角度分析,与对照组相比,饲料中EKP的适量添加提高了幼参体壁中Met和Cys含量,原因是Met和Cys的表观消化率的变化,氨基酸消化吸收程度越高,对幼参体壁氨基酸沉积的影响也就越大。
在饲料中添加适量的EKP能显著提高幼参肠道蛋白酶和淀粉酶活性,有助于幼参对蛋白质和糖类的消化吸收,进而影响幼参生长。海带粉经酶解处理后释放了非淀粉多糖和大分子蛋白质,使还原糖和可溶性蛋白含量显著提高,幼参更容易吸收,从而诱导性的提高幼参肠道中蛋白酶和淀粉酶活性。但是幼参肠道脂肪酶并不受EKP添加的影响,其原因是酶解处理后的酶解海带粉脂肪的含量并没有发生明显的变化。
水产动物利用葡萄糖的方式与哺乳动物类似,都是糖酵解和糖异生协同发挥作用,以维持动物体内葡萄糖的稳态(Sergio et al, 2012)。GK和PK是糖酵解途径中两个关键性限制酶,由于GK的Km值很低,只有在细胞内葡萄糖浓度足够高时才有效,因此,GK的活性可作为判断细胞对葡萄糖利用的指标。PEPCK是糖异生途径的催化酶,可以将乳酸和氨基酸等非糖类物质经糖异生途径转化为葡萄糖,维持机体内葡萄糖的稳态。本研究中,当EKP含量从0提高到9%时,GK和PK活性显著升高,当EKP含量从12%到15%时,GK和PK活性显著降低,这表明适量的EKP对刺参糖酵解有促进作用。PEPCK活性随着EKP含量的增加呈先升高后下降的趋势,在12%组达到最大值。这说明随着EKP添加量的提高,同时促进了糖酵解和糖异生代谢反应,但当添加量达到12%时,刺参肠道细胞的糖酵解减弱而糖异生过程增强,说明在9%~12%添加水平已经满足刺参对糖的需求,机体内过量的葡萄糖被转运出细胞外。ATP酶在葡萄糖和氨基酸等营养物质的吸收过程中,起着重要的作用。Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶是细胞膜上重要的酶蛋白(段树丽, 2021),ATP酶活性的升高有助于细胞内能量代谢、离子转运和信息传递,对维持细胞的生理功能有重要的作用。本研究中,幼参肠道中的Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活力均呈现出随着EKP含量的升高而逐渐升高的趋势,这表明饲料中添加EKP提高了营养物质的水解供能。另外,本研究中发现,在中低添加水平下(3%~12%) ALT和AST活性显著升高,但高添加水平则抑制二者的活性。ALT和AST是动物体内蛋白质代谢过程中的2个关键代谢酶,其活力的高低一定程度上反映了机体对蛋白质的合成和分解能力(Yan et al, 2007)。因此,这种现象表明饲料中添加适量的EKP能在一定程度上提高幼参肠道对蛋白质的代谢处理能力,过量添加反而会给幼参肠道增加代谢负担,不利于蛋白的消化。
生物机体内关键性的抗氧化因子主要包括SOD、T-AOC和CAT等。SOD是动物体内关键的抗氧化酶之一,是超氧自由基的天然消除剂,使自由基的形成与消除处于一种动态平衡中,从而避免其对生物分子的损伤等(吴阳, 2012)。T-AOC的强弱与健康程度密切相关,该防御体系由酶促和非酶促2个体系组成,协同防护机体氧化。MDA是多不饱和脂肪酸受氧自由基攻击形成的脂质过氧化产物,反映了细胞的受损伤程度和脂质过氧化程度(Marcelo et al, 2000)。本研究表明,SOD活性随着EKP含量的升高呈先升高后下降的趋势。可能是随着EKP含量的增加,幼参肠道在代谢过程中增强了呼吸链传递通路所介导的能量代谢,从而提高了活性氧的产生,幼参机体为了消除活性氧维持稳态从而提高抗氧化酶的合成速度。当EKP含量过高时,打破了活性氧自由基的动态平衡,对细胞产生一定的毒害作用,从而抑制了SOD的产生。杜以帅(2010)将褐藻寡糖和海藻粉饲喂刺参40 d后,刺参体腔液和体壁中SOD活性有一定程度地提高,并呈先升高后下降的趋势,这与本研究结果一致。Hu等(2021)研究表明,在草鱼(Ctenopharyngodon idella)饲料中添加100~400 mg/kg褐藻酸寡糖,能显著提高SOD和CAT活性,并降低MDA水平,从而提高草鱼的抗氧化能力。本研究中,T-AOC活性随着EKP含量的升高呈先升高后下降的趋势,当EKP添加水平为9%时,T-AOC活性达到最大。与之相反的是,MDA含量随着EKP添加水平的提高呈下降趋势,当EKP含量达到12%时,MDA含量显著升高,MDA含量越高,表明细胞毒性越大,对细胞和机体造成损伤。这表明在幼参饲料中添加EKP不应超过12%,9%以下的添加量有助于提高刺参机体抗氧化能力,并降低脂质过氧化物对细胞的伤害,从而保护机体免受自由基的损伤。
4 结论综上所述,本实验条件下,以增重率为评价指标,经一元二次回归分析(y=–0.198x2+4.102 9x+60.586)得出,体质量为(11.40±0.04) g的刺参饲料中EKP的最适添加量为10.36%。饲料中添加6%~12% EKP可以提高刺参幼参对营养物质的消化和代谢能力,增强幼参的抗氧化性能,进而促进幼参的生长。
BALBAS J, HAMID N, LIU T T, et al. Comparison of physicochemical characteristics, sensory properties and volatile composition between commercial and New Zealand made wakame from Undaria pinnatifida. Food Chemistry, 2015, 186(5): 168-175 |
BEDFORD M R, CLASSEN H L. Reduction of intestinal viscosity through manipulation of dietary rye and pentosanase concentration effected through changes in carbohydrate: Composition of the aqueous phase and results in improved growth rates and food conversion efficiency in chicks. The Journal of Nutrition, 1992, 122(3): 560-569 DOI:10.1093/jn/122.3.560 |
CAO X Y. Reasonable use of enzyme preparation in feed. Rural Breeding Technology, 2013(10): 59 [曹新勇. 酶制剂在饲料中的合理使用. 农村养殖技术, 2013(10): 59] |
CHENG L, LI J. Determination of reducing sugar and total sugar in hawthorn tablets by 3,5-dinitrosalicylic acid method. Light Industry Science and Technology, 2016, 32(3): 25-28 [程柳, 李静. 3,5-二硝基水杨酸法测定山楂片中还原糖和总糖含量. 轻工科技, 2016, 32(3): 25-28] |
DONG X Q, ZHANG Y M, ZHANG Y G, et al. Study on comprehensive extraction process of fucoidan and alginc acid from Laminaria japonica by complex enzymatic method. China Food Additives, 2017, 4(9): 171-176 [董学前, 张艳敏, 张永刚, 等. 复合酶法综合提取海带中褐藻糖胶与海藻酸的研究. 中国食品添加剂, 2017, 4(9): 171-176] |
DU Y S. The effect of enzymatic hydrolyzed seaweed products on the intestinal flora and immune-related factors of sea cucumber (Apostichopus japonicus). Master′s Thesis of Ocean University of China, 2010 [杜以帅. 酶解海藻产物对刺参(Apostichopus japonicus)肠道菌群和免疫相关因子的影响. 中国海洋大学硕士研究生学位论文, 2010]
|
DUAN S L. Effects of angelica on Na+-K+-ATPase and Ca2+-Mg2+-ATPase in blood deficiency rats. Gansu Animal Husbandry and Veterinary, 2021, 51(4): 50-53 [段树丽. 当归对血虚大鼠Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的影响. 甘肃畜牧兽医, 2021, 51(4): 50-53] |
FU Y H, WANG Q Y, FU X J, et al. Different extraction process of fucoidan from kelp. The Food Industry, 2019, 40(8): 49-53 [付燕红, 王庆玉, 付学军, 等. 海带中褐藻糖胶不同提取工艺. 食品工业, 2019, 40(8): 49-53] |
GUAN Y, XUE M, WANG W. The latest research progress of feed enzyme preparation in aquatic animals. Chinese Fishery Quality and Standards, 2021, 11(1): 61-67 [关莹, 薛敏, 王伟. 饲用酶制剂在水产动物中应用的最新研究进展. 中国渔业质量与标准, 2021, 11(1): 61-67] |
GUO N, YAO Z A, YU G Y, et al. Effects of enzymatic hydrolysate of Laminaria japonica on growth and immune-related factors of sea cucumber. China Brewing, 2019, 38(4): 160-164 [郭娜, 姚子昂, 于国友, 等. 海带酶解产物对海参生长及其免疫相关因子的影响. 中国酿造, 2019, 38(4): 160-164] |
HU J F, ZHANG J M, WU S J. The growth performance and non-specific immunity of juvenile grass carp (Ctenopharyngodon idella) affected by dietary alginate oligosaccharide. 3 Biotech, 2021, 11(2): 46-46 DOI:10.1007/s13205-020-02589-4 |
JIANG X L, DU Y S, WANG P, et al. Effects of alginate-derived oligosaccharide on the activities of immune enzymes in the coelomic fluid and body wall of sea cucumber (Apostichopus japonicus). Periodical of Ocean University of China, 2009, 39(6): 1188-1192 [江晓路, 杜以帅, 王鹏, 等. 褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响. 中国海洋大学学报(自然科学版), 2009, 39(6): 1188-1192] |
LI M, LIAO M J, WANG Y G, et al. Effects of enteromorpha prolifera adding ratio and microbial fermentation on growth, digestion and non-specific immune of juvenile sea cucumbers (Apostichopus japonicus Selenka). Chinese Journal of Animal Nutrition, 2015, 27(10): 3270-3278 [李猛, 廖梅杰, 王印庚, 等. 浒苔添加比例与微生物发酵对幼刺参生长、消化和非特异性免疫的影响. 动物营养学报, 2015, 27(10): 3270-3278] |
MARCELO M, RICCARDO C, JENNY R, et al. Measurement of reactive oxygen intermediate production in haemocytes of the penaeid shrimp, Penaeus vannamei. Aquaculture, 2000, 191(1): 89-107 |
PENG S X. Effects of kelp meal adding proportion and its enzymatic hydrolysates on growth, digestion and non-specific immunity of Litopenaeus vannamei. Master′s Thesis of Shanghai Ocean University, 2017 [彭素晓. 海带渣的酶解工艺优化及在对虾养殖中的应用. 上海海洋大学硕士研究生学位论文, 2017]
|
QIN B, CHANG Q, CHEN S Q, et al. Effects of dosage and treatments of enteromorpha prolifera on growth, digestibility, digestive enzymes and non-specific immunity enzymes of juvenile sea cucumber (Apostichopus japonicus Selenka). Journal of Fisheries of China, 2015, 39(4): 547-556 [秦搏, 常青, 陈四清, 等. 饲料中浒苔添加量以及处理方法对幼刺参生长、消化率、消化酶和非特异性免疫酶的影响. 水产学报, 2015, 39(4): 547-556] |
SERGIO P, STEPHANE P, JOSE L S, et al. Glucose metabolism in fish: A review. Journal of Comparative Physiology, 2012, 182(8): 1015-1045 |
SONG Z D, LI P Y, WANG J Y, et al. Effects of seaweed replacement by hydrolyzed soybean meal on growth, metabolism, oxidation resistance and body composition of sea cucumber Apostichopus japonicus. Aquaculture, 2016, 463: 135-144 |
SUN Y T. The use of kelp powder in feeding. Jiang Xi Feed, 2015(4): 23–25, 32 [孙永泰. 海带粉在饲料中的应用. 江西饲料, 2015(4): 23–25, 32] |
TAKESHI Y, TATSUYA U, TOSHIO A. The influence of dietary protein sources on tissue free amino acid levels of fingerling rainbow trout. Japanese Society of Fisheries Science, 2000, 66(2): 310-320 |
WANG C Y, SHAN S S, XU S A. Preliminary study on enzymolysis of non-starch polysaccharide in feed seaweed powder using pre-digestion method. Feed Industry, 2012, 33(2): 44-48 [王昌义, 单守水, 徐世艾. 预消化法酶解饲用海藻粉中非淀粉多糖的初步研究. 饲料工业, 2012, 33(2): 44-48] |
WANG J X, WEI Y L, XU H G, et al. Apparent digestibility coefficients of selected feed ingredients for juvenile tiger puffer (Takifugu rubripes). Progress in Fishery Sciences, 2021, 42(2): 96-103 [王建学, 卫育良, 徐后国, 等. 红鳍东方鲀对8种饲料原料的表观消化率. 渔业科学进展, 2021, 42(2): 96-103] |
WANG L L, MEI W Q, CHEN X L, et al. Determination of water-soluble sugar in rice by 3,5-dinitrosalicylic acid colorimetric method. Journal of the Chinese Cereals and Oils Association, 2020, 35(9): 168-173 [王莉丽, 梅文泉, 陈兴连, 等. 3,5-二硝基水杨酸比色法测定大米中水溶性糖含量. 中国粮油学报, 2020, 35(9): 168-173] |
WANG Y N. Kinds of enzyme preparations used in aquatic animal feeds and their action mechanisms. New Feed, 2013(8): 38-39 [王亚妮. 水产动物饲用酶制剂种类及其作用机理. 饲料与畜牧, 2013(8): 38-39] |
WU Y. Effects of oligosaccharides and probiotics on the growth, digestion, immune and anti-oxidation of bream. Master′s Thesis of Nanjing Agricultural University, 2012 [吴阳. 寡糖和益生菌对团头鲂生长、消化及免疫抗氧化的影响. 南京农业大学硕士研究生学位论文, 2012]
|
YAN Q, XIE S, ZHU X, LEI W, et al. Dietary methionine requirement for juvenile rockfish, Sebastes schlegeli. Aquaculture Nutrition, 2007, 13(3): 163-169 |
YAO J, ZHANG H, GUO S, et al. The research status of laminaria japonica aresch biological activity and the development of series product. Food Research and Development, 2018, 39(8): 198-202 [姚骏, 张弘, 郭森, 等. 海带的生物活性及系列产品开发研究进展. 食品研究与开发, 2018, 39(8): 198-202] |
ZHANG D R, ZHANG L M, MA J J, et al. Effect of dietary dried distiller′s grains with solubles (DDGS) on the growth, body composition, and immune enzymes activities of sea cucumber (Apostichopus japonicus). Progress in Fishery Sciences, 2016, 37(6): 115-122 [张德瑞, 张利民, 马晶晶, 等. 配合饲料中添加玉米DDGS对刺参(Apostichopus japonicus)生长、体组成及免疫指标的影响. 渔业科学进展, 2016, 37(6): 115-122] |
ZHAO Y C, ZHANG Q, YUAN L, et al. Effects of dietary taurine on the growth, digestive enzymes, and antioxidant capacity in juvenile sea cucumber, Apostichopus japonicus. Journal of the World Aquaculture Society, 2017, 48(3): 478-487 |



