刺参(Apostichopus japonicus)是我国重要的海水养殖品种之一,广泛分布于辽宁、山东和河北沿海地区。刺参在我国水产品行业具有极高的经济和产业价值,根据2021年中国渔业统计年鉴的数据显示,2020年刺参的养殖产量为19.65万t,经济产值近600亿元。刺参除了具有极高的经济价值外,还具有夏眠和再生等生物学特性,因此,也成为研究组织、器官发育和进化的良好模型(常亚青等, 2004)。
刺参为雌雄异体生物,不同性别刺参在生长速度、免疫能力等方面具有显著差异。研究表明,产卵后,雄性刺参与雌性刺参相比具有较快的生长速度(Jiang et al, 2020),且雄性刺参比雌性刺参具有更强的免疫活性(Jiang et al, 2019、2017)。针对刺参性腺发育机制、性别决定和性别分化相关的研究逐渐成为热点之一(孙志惠等, 2021)。目前,针对刺参性腺发育机制的研究多集中在组织学观察、转录组测序及性腺发育相关基因的鉴定等方面。研究表明,最早可在体长为0.1 cm的稚参中观察到原始性腺(晏萌等, 2011),随后其性腺开始出现管腔并不断拉长变宽、产生分支,再由分支汇集成生殖总管,最后生殖总管变细进入生殖孔中(隋锡林等, 1985)。鉴定性腺发育相关基因是解析性腺发育机制的重要途径,随着刺参基因组测序的完成(Zhang et al, 2017),从基因组水平陆续鉴定了一些与刺参性腺发育相关的基因,如piwi1 (Sun et al, 2021)、dmrt、vasa、nodal (Sun et al, 2022)、foxl2 (Sun et al, 2022)等,但刺参的性腺发育机制仍是谜团。
germ cell-less基因在果蝇(Drosophila)的生殖系形成中被首次鉴定(Jongens et al, 1992),germ cell- less基因中包含一个进化上保守的BTB/POZ结构域。BTB/POZ(简称BTB)结构域几乎存在于所有真核细胞中,由约115个氨基酸残基组成,能够介导蛋白与蛋白之间形成同源或异源二聚体(Puccetti et al, 2001; Sameshima et al, 2018),BTB结构域与哺乳动物的性腺发育息息相关(Chaharbakhshi et al, 2016)。Germ cell-less基因在果蝇原始生殖细胞(primordial germ cell, PGC)中高表达,是参与PGC形成的一个重要的母源因子(Jongens et al, 1992; Kimura et al, 1999; Leatherman et al, 2000; Scholz et al, 2004),对维持转录沉默及PGC存活具有重要作用。随后,germ cell-less的同源基因在其他脊椎动物物种中被陆续鉴定,如小鼠(Mus musculus)中germ cell-less同源基因(mgcl-1)在PGC中表达量较低,但在成体睾丸中高表达,卵巢中低表达(Leatherman et al, 2000)。mgcl-1基因缺失会导致小鼠部分器官的核结构异常。值得注意的是,该基因缺失会使精母细胞核畸变,进而影响染色质重塑,导致精子形态缺陷(Kimura et al, 2003)。斑马鱼(Danio rerio)中,germ cell-less mRNA在PGCs中特异表达,意味着斑马鱼的PGCs形成需要germ cell-less基因参与。无脊椎动物尤其是棘皮动物中germ cell-less基因的研究较少。
本研究克隆了刺参germ cell-less (Ajgcl)基因的全长cDNA序列,利用荧光定量PCR (RT-qPCR)技术分析Ajgcl基因在成体各组织、胚胎不同发育时期和性腺不同发育阶段的动态表达情况,调取并下载Ajgcl的启动子序列,预测其潜在调控因子,以期为解析germ cell-less基因在刺参的生殖细胞发育和性腺发育中发挥的功能奠定基础。
1 材料与方法 1.1 材料本实验所用刺参取自大连海洋大学农业农村部北方海水增养殖重点实验室。2021年2—7月,每个月进行一次取样工作,从实验室自繁刺参家系中选取体重为100 g左右的2~3龄刺参,解剖刺参后取性腺、体壁、管足、肠、胃、纵肌、体腔细胞和呼吸树等组织样品,每个组织取约100 mg样品于无酶离心管中,立即置于液氮中速冻,并放到–80 ℃冰箱保存备用。通过性腺样品组织学检测分析刺参的性别及性腺所处发育时期,每次取样均含3只雌性和3只雄性刺参。
2021年5月,选取生长状态良好的刺参,用0.5 mol/L的KCl和1 µmol/L的天冬氨酸-甘氨酸-亮氨酸-色氨酸-酪氨酸(NGLWY)五肽酰胺(Cubifrin-L)诱导繁殖,分别收集精子和卵子后,人工授精,用海水灌洗3次受精卵以洗去多余的精子,将胚胎置于过滤海水中培养。随后,收集刺参不同发育阶段的样本,包括受精卵、2细胞期、32细胞期、囊胚期、囊胚后期、原肠期、小耳幼体、大耳幼体、樽形幼体、五触手幼体,取每个时期约100 mg样品于无酶离心管中,立即置于液氮中速冻,并于–80 ℃冰箱保存备用。研究未涉及任何濒危或受保护物种。
1.2 总RNA的提取及cDNA的合成总RNA的提取参照SV Total RNA isolation system (Promaga Z3100)说明书进行,利用琼脂糖凝胶电泳和微量分光光度计检验所提取的RNA的浓度及质量。选取性腺发育处于生长期的雌性性腺样品的总RNA 1 µg,按照SMARTerTM RACE cDNA扩增试剂盒(Clontech 634923)说明书构建到加接头的cDNA集合。同时,取0.5 µg各成体组织及胚胎发育时期样品的总RNA,按照PrimerScriptTM RT试剂盒(TaRaKa 634860)说明书合成cDNA。
1.3 cDNA全长克隆以斑马鱼germ cell-less基因的氨基酸序列为查询序列,在刺参基因组数据库中进行比对查询,得到刺参germ cell-less基因片段。随后,通过5´和3´RACE (rapid amplification of cDNA ends) PCR,按照SMARTerTM RACE cDNA扩增试剂盒(Clontech 634923)说明书克隆刺参germ cell-less基因的cDNA全长。实验所用引物见表 1,由网站(http://biotools.nubic.northwestern.edu/OligoCalc.html)和软件Primer Premier 5.0设计。
|
|
表 1 本实验所用引物 Tab.1 Sequences of the primers used in this study |
使用NCBI中的ORF-Finder,预测germ cell-less基因的开放阅读框(open reading frame, ORF),随后使用NCBI中的Splign工具比对出germ cell-less基因的外显子和内含子位点;使用SMART (http://smart.embl-heidelberg.de/)预测Germ cell-less蛋白结构域,然后用ExPASy中的Protparam工具(https://web.expasy.org/protparam/)预测Germ cell-less蛋白的基本理化性质;使用Predict Protein (https://www.predict protein.org/)分析Germ cell-less蛋白的二级结构;利用Swiss-model (https://swissmodel.expasy.org/)分析其三级结构;最后利用ClustalW进行多重序列比对,并使用MEGA7进行系统发生树分析,实验所用基因序列的NCBI登录号见表 2。
|
|
表 2 多重序列比对和系统进化树所用的germ cell-less同源基因 Tab.2 Information on germ cell-less homologous for multiple sequence alignment and phylogenetic analysis |
在刺参基因组数据库中调取并下载germ cell-less基因起始密码子(ATG)上游2 000 bp序列,利用Match (http://gene-regulation.com/cgi-bin/pub/programs/match/bin/match.cgi)对其启动子序列进行转录结合位点预测。
1.6 RT-qPCR检测基因表达RT-qPCR在LightCycler® 96 Instrument (Roche)上进行,反应体系(共20 µL):fast start essential DNA green master为10 µL,上、下游引物(10 µmol/L)各0.8 µL,cDNA为2 µL,DEPC H2O为6.4 µL。RT-qPCR程序:95 ℃预变性10 min;95 ℃循环变性15 s;60 ℃退火复性60 s,共40个循环;95 ℃ 10 s;65 ℃ 60 s;97 ℃ 1 s。以NADH作为内参基因,根据2–ΔΔCt方法计算基因表达量。利用SPSS 25.0软件进行数据统计分析,采用单因素方差(one-way ANOVA)分析,选择Duncan法进行组间多重对比,显著性差异水平数值设置为0.05。
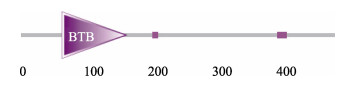
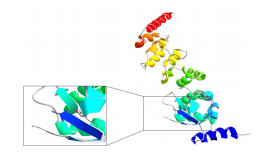
2 结果与分析 2.1 germ cell-less cDNA全长序列及其编码的蛋白结构预测分析本研究从雌性性腺cDNA文库中克隆得到刺参germ cell-less基因的cDNA全长(NCBI序列号:ON932433),序列全长为2 316 bp,5´UTR为139 bp,3´UTR为725 bp,ORF长度为1 455 bp,共编码484个氨基酸(图 1)。与刺参全基因组比对得出,germ cell- less基因编码区共存在15个外显子序列和内含子序列,其中,外显子序列最长为141 bp (图 1)。结构域预测结果显示,Ajgcl具有一个保守的BTB (Broad- Complex, Tramtrack and Bric a brac)结构域(图 2)。Ajgcl蛋白的理论分子质量为55.40 kDa,理论等电点为5.80,为亲水性蛋白。Ajgcl的蛋白二级结构中α-螺旋(alpha helix, H)、延长链(extended strand, E)和无规则卷曲(random coil, C)的占比分别为35.40%、18.84%和45.76% (图 3)。蛋白质三级结构中显示,Ajgcl蛋白含有锌指结构,此结构能与DNA特异性结合(图 4)。

|
图 1 germ cell-less基因外显子序列和内含子序列 Fig.1 Exon and intron sequences of germ cell-less 绿色字母表示起始密码子ATG和终止密码子TAA,红色方框表示基因的内含子序列,其余部分表示DNA外显子序列。 ATG and TAA are in green. The red frames indicate the intron sequences, and the rest of letters indicate the exon sequences. |
|
图 2 Germ cell-less蛋白结构域预测 Fig.2 Prediction of Germ cell-less protein domain Germ cell-less蛋白结构域预测为BTB/POZ结构域,长度为101 aa (63~163),紫色方框表示低复杂度区域:ELLLELSLDL长度为10 aa (202~211),SSSISMQSHRSIMIRI长度为16 aa (394~409)。 The prediction of Germ cell-less protein is BTB/POZ domain which contains 101 aa (63~163), purple frames indicate low complexity regions: ELLLELSLDL contains 10 aa (202~211), and SSSISMQSHRSIMIRI contains 16 aa (394~409). |

|
图 3 Germ cell-less蛋白质的二级结构预测 Fig.3 Prediction of Germ cell-less protein secondary structure 黄色条表示延长链,粉色条表示α-螺旋,灰色线条表示无规则卷曲。 Yellow stripes indicate extended strand, pink stripes indicate alpha helix, and grey lines indicate random coil. |
|
图 4 Germ cell-less蛋白质三级结构预测 Fig.4 Prediction of Germ cell-less protein tertiary structure 黑色框内表示Germ cell-less蛋白的锌指结构区域。 The black box indicates the Zinc finger structural area of Germ cell-less. |
从NCBI网站下载其他物种中germ cell-less的同源基因,进行氨基酸序列比对分析。结果表明,刺参germ cell-less基因与紫球海胆(Strongylocentrotus purpuratus) germ cell-less基因的氨基酸序列一致性最高,为55.38%,与棘冠海星(Acanthaster planci) germ cell-less基因的一致性为52.34%,与其他非棘皮动物门的物种如爪蟾(Xenopus laevi)、斑马鱼、金鱼(Carassius auratus)、黑棘鲷(Acanthopagruss chlegelii)、小鼠和人(Homo sapiens)的一致性较低,分别为44.98%、44.86%、43.87%、43.08%、42.00%、42.02% (图 2)。此外,其BTB/POZ结构域在进化上较为保守,不同物种中的一致性为74.09%~59.59% (图 5A)。基于以上氨基酸序列比对的结果,构建了系统进化树。结果表明,刺参、紫球海胆和棘冠海星的germ cell-less氨基酸序列聚为一支,germ cell-less基因的聚类结果和物种进化趋势基本一致(图 5B)。

|
图 5 Germ cell-less的BTB/POZ结构域多重氨基酸序列比对(A)及其氨基酸序列的系统进化树(B) Fig.5 Multiple amino acid sequence alignment in the BTB/POZ domain (A) and phylogenetic tree of Germ cell-less amino acid sequence (B) |
利用在线分析网站对germ cell-less基因的起始密码子上游2 000 bp序列进行转录因子结合位点预测分析。结果显示,在其启动子序列中,有4个Oct-1和4个FOXD3结合位点,以及c-Myb、NF-1、CRP、PAX-6等的结合位点(图 6)。

|
图 6 germ cell-less基因的启动子序列和潜在的转录结合位点 Fig.6 The sequence of the promoter region and potential transcription factor binding sites of germ cell-less 带黑色下划线的字母为潜在的转录结合位点,带红色下划线的字母为TATA-box结合位点。红色字母为起始密码子。字母左侧的数字表示启动子序列位置(ATG前的第1个字母设为–1并为蓝色)。 Black-underlined letters show the potential transcription factor bindings, and red-underlined letters show the TATA-box bindings. ATG are in red. The numbers to the left of letters represent the positions of the promoter region. (The first letter before ATG was set as –1 in blue). |
RT-qPCR结果表明,在刺参的性腺、肠、胃、纵肌、呼吸树、管足和体腔细胞中均检测到germcell-less转录本。其中,在雌性性腺中表达量最高,雌性性腺中的表达量是雄性性腺中表达量的2.25倍。其余组织中相对表达量从高到低排序为管足 > 肠 > 体腔细胞 > 胃 > 呼吸树 > 纵肌,但在刺参体壁中未检测出germ cell-less转录本(图 7)。

|
图 7 germ cell-less基因组织表达的RT-qPCR分析 Fig.7 RT-qPCR analysis of germ cell-less expression in adult tissues 使用单因素方差检验进行数据分析。将germ cell-less在卵巢中的表达量设为1。条带代表平均值±标准差。以NADH为内参。不同字母表示存在显著差异(P≤0.05)。下同。 One-way ANOVA test was used to perform statistical analysis. The expression of germ cell-less in ovary was set to 1. Each bar indicates Mean±SD. NADH was used as the control. Different letters represent significant differences among the tissues (P≤0.05). The same as below. |
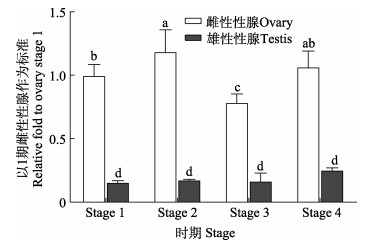
鉴于germ cell-less基因在刺参性腺中表达量最高,通过持续采样,获得刺参性腺不同发育时期的样本。前期研究表明,刺参的性腺发育分为4个时期,分别为增殖期(Stage 1)、生长期(Stage 2)、成熟期(Stage 3)和放出期(Stage 4)(隋锡林等, 1985; Yan et al, 2013)。随后利用RT-qPCR检测不同发育时期germ cell-less基因的动态表达情况。结果显示,在雌性性腺中,与增殖期相比,生长期中germ cell-less基因表达量轻微升高(图 8);随着雌性性腺发育到成熟期时,其表达量显著下调,与增殖期相比下调至0.79。配子发生结束后,其表达量又恢复到原有的水平。在雄性性腺中,germ cell-less在4个时期中的表达量变化不大,都处于较低的表达水平。将雌性性腺和雄性性腺中germ cell-less相对表达量比较后,雌性性腺中的表达量远远高于雄性性腺中的表达量,甚至在生长期中表达量达到了雄性性腺中的6.7倍。
|
图 8 germ cell-less基因在性腺不同发育时期的动态表达分析 Fig.8 Dynamic expression analysis of germ cell-less gene in gonads at different development stages Stage 1:增殖期;Stage 2:生长期;Stage 3:成熟期;Stage 4:放出期。 Stage 1: Early growing stage; Stage 2: Growing stage; Stage 3: Mature stage; Stage 4: Post-spawning stage. |
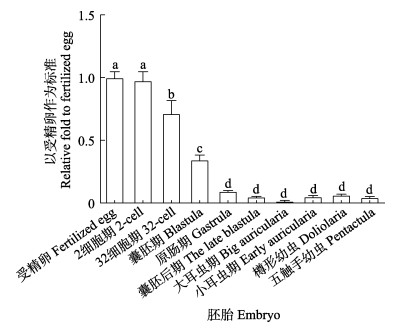
如图 9所示,在受精卵、2细胞期、32细胞期时胚胎样品中均可检测出大量的germ cell-less转录本,表明germ cell-less基因是母源因子。随着胚胎发育的进行,囊胚期其表达量急剧降低,随后表达量维持在较低水平。
|
图 9 germ cell-less基因胚胎发育时期的表达分析 Fig.9 Expression analysis of germ cell-less gene in embryo |
本研究首次克隆获得刺参germ cell-less基因的cDNA序列全长,共编码484个氨基酸。Germ cell-less基因是BTB/POZ蛋白家族中的一员,该蛋白家族BTB结构域几乎存在于所有的真核细胞中,且与动物的性腺发生、生殖细胞生长发育和分化息息相关(Bardwell et al, 1994)。BTB/POZ结构域通常存在于蛋白质氨基端末尾,是一个保守且具有疏水性的结构域。其在果蝇(Drosophila melanogaster)的ttk基因和BR-C基因比对中首次被证实功能(Numoto et al, 1993; Sugawara et al, 1994)。值得注意的是,ttk基因是果蝇胚胎发育所必需的基因,果蝇ttk基因的BTB/POZ结构域能够特异性与自身结合形成同源二聚体(Bardwell et al, 1994)。此外,Albagli等(1995)研究表明,一部分具有BTB/POZ结构域的蛋白能影响染色质缩合,可能会进而影响生殖细胞减数分裂的效率和质量;其他具有此结构域的蛋白甚至自身就是一种肌动蛋白结合蛋白,结合后可能影响生殖细胞发生过程中的细胞骨架重排。而刺参Germ cell-less蛋白三级结构显示,该基因存在能与DNA特异结合的锌指结构,这也暗示刺参germ cell-less基因可能参与核中高级大分子复合物的形成,如胚胎极细胞的形成。
3.2 刺参germ cell-less基因转录结合位点预测分析通过在线工具预测出刺参germ cell-less基因启动子中存在Oct-1、FOXD3、c-Myb、NF-1、CRP、PAX-6等的转录结合位点。Oct-1是一种普遍存在的活性转录因子,但其功能在不同调控通路中存在差异。一般情况下,Oct-1可作为转录激活剂,通常需要辅助因子的帮助(Inamoto et al, 1997)。研究表明,无论是在人体肝脏还是海拉细胞(Hela cells)中,只有Oct-1转录位点存在,才能使HNF-1转录因子与其协同激活preS1启动子转录,否则二者都无法单独激活preS1启动子的转录(Zhou et al, 1991);同时,在小鼠中,Oct-1还可以通过与催乳素受体(STAT-5)以及糖皮质激素受体(GR)相互作用来参与乳蛋白β-酪蛋白转录的激素调节(Dong et al, 2009)。Oct-1还可启动并调控海胆早期幼虫的nodal和vg1/univin基因,若抑制Oct-1 mRNA翻译会造成海胆早期胚胎发育为放射状,即腹侧不再呈平坦状且腹侧初级间充质细胞簇(primary mesenchymal cells, PMC)不再组织聚集等海胆胚胎发育缺陷(Range et al, 2011)。此外,Oct-1也能抑制一些基因的转录。Oct-1转录因子能够与大鼠(Rattus norvegicus) CYP1A1基因的一部分负调控元件相互作用,以抑制该基因的表达(Brat et al, 1996)。有趣的是,Oct-1还可以通过涉及核小体重塑和组蛋白去乙酰化(NuRD)的机制维持抑制,然后,又能通过涉及Jmjd1a组蛋白的抗抑制机制来维持平衡的基因表达。可以推测Oct-1在该环境下又可作为一种可切换的转录调节因子(Shakya et al, 2011)。FOXD3则是胚胎发育的转录调控因子之一,是小鼠外胚层形成的一个必要因素(Hanna et al, 2002),若将FOXD3敲除,胚胎将会死亡并导致上皮细胞缺失。在斑马鱼中,FOXD3通过诱导神经嵴细胞中谱系相关转录因子的表达来调节这些细胞的迁移,以选择性地指定迁移前神经嵴细胞的神经元、神经胶质或软骨的发展结果(Stewart et al, 2006)。此外,FOXD3也是爪蟾神经嵴发育的重要上游调控因子(Sasai et al, 2001)。而以上转录因子在刺参中的作用尚不明显,因此,Oct-1、FOXD3、c-Myb等在刺参生殖发育中的作用值得进一步探究。
3.3 刺参germ cell-less基因在组织及性腺不同发育时期中的表达情况不同种类动物germ cell-less基因的表达模式存在差异。在果蝇中,germ cell-less基因在卵母细胞中表达,而其蛋白则在极细胞以及极细胞的核膜中被检测到(Jongens et al, 1992)。在小鼠中,精巢内可检测到大量germ cell-less基因表达,而在卵巢及其他成体组织中未检测到表达(Kimura et al, 1999; Leatherman et al, 2000)。青鳉(Oryzias latipes)中,germ cell-less基因在卵巢中的表达量较高,而精巢中表达量相对较低(Scholz et al, 2004)。刺参germ cell-less基因表达模式明显有别于其他物种,刺参germ cell-less基因在成体组织中呈泛表达状态,且在雌性性腺中的表达量远远高于雄性性腺中的表达量,甚至在生长期中表达量达到了雄性性腺的6.7倍。此外,不同物种germ cell-less基因的功能也存在差异。在斑马鱼中,germ cell-less在PGCs中特异且大量表达,这也暗示着germ cell-less基因是斑马鱼PGCs形成发生所必不可少的组成基础。在果蝇中,germ cell-less基因被证实过量表达会导致有丝分裂延迟(Jongens et al, 1994)。有趣的是,小鼠mgcl-1基因通过自身BTB/POZ结构域与调控细胞周期进入S期的E2F转录因子相结合,进而导致细胞周期阻滞(de la Luna et al, 1999)。germ cell-less基因在刺参生殖细胞分裂分化和增殖过程中可能发挥保守功能。
3.4 刺参germ cell-less基因在早期胚胎发育过程中的表达情况脊椎动物中,小鼠mgcl-1基因在初级精母细胞中高表达,尤其在粗线期精母细胞中,但精原细胞和精细胞中却检测不到germ cell-less基因(Kimura et al, 1999)。硬骨鱼类中,germ cell-less基因作为母源因子在斑马鱼胚胎发育早期高度表达,但随着胚胎发育进程其表达量相对降低(Li et al, 2006)。同样,在青鳉中,germ cell-less基因在胚胎发育前期高表达,但随后便消失,直至孵化后才能被检测到(Scholz et al, 2004)。无脊椎动物中,暂没有相关报道。但与germ cell-less基因同为母源因子的piwi基因在刺参的早期胚胎发育过程中也存在类似的表达模式,受精卵中piwi基因呈高表达状态,随着胚胎发育,piwi基因的表达便迅速下调并呈较低水平(Sun et al, 2021)。而刺参中germ cell-less基因在刺参胚胎发育早期呈高表达,随着胚胎发育的进行,其表达量逐渐下调,特别是囊胚期后出现指数型下降,之后一直保持低水平表达(图 9)。因此,推测germ cell-less基因作为母源因子可能和piwi基因一起调控刺参早期生殖细胞发育。
4 结论本研究对刺参germ cell-less基因进行了表达特性分析与启动子生物信息学分析,揭示了其分子特征,并阐明了其在刺参成体组织中呈泛表达,雌性性腺高表达的表达特性。此外,还揭示了刺参germ cell-less是母源因子,在刺参胚胎发育过程中可检测到大量转录本,且其启动子序列中存在Oct-1、FOXD3等转录因子的结合位点。综上,本研究为揭示germ cell-less基因在刺参性腺形成、分化和发育中发挥的作用提供了重要支撑。
ALBAGLI O, DHORDAIN P, DEWEINDT C, et al. The BTB/POZ domain: A new protein-protein interaction motif common to DNA- and actin-binding proteins. Cell Growth and Differentiation: the Molecular Biology Journal of the American Association for Cancer Research, 1995, 6(9): 1193-1198 |
BARDWELL V J, TREISMAN R. The POZ domain: A conserved protein-protein interaction motif. Genes and Development, 1994, 8(14): 1664-1677 DOI:10.1101/gad.8.14.1664 |
BRAT R, WEAVER J A, STERLING K M, et al. Nuclear transcription factor Oct-1 binds to the 5′-upstream region of CYP1A1 and negatively regulates its expression. International Journal of Biochemistry and Cell Biology, 1996, 28(2): 217-227 DOI:10.1016/1357-2725(95)00122-0 |
CHAHARBAKHSHI E, JEMC J C. Broad-complex, tramtrack, and bric-à-brac (BTB) proteins: Critical regulators of development. Genesis, 2016, 54(10): 505-518 DOI:10.1002/dvg.22964 |
CHANG Y Q, DING J, SONG J, et al. Biological research and breeding of sea cucumber and sea urchin. Beijing: China Ocean Press, 2004 [常亚青, 丁君, 宋坚, 等. 海参、海胆生物学研究与养殖. 北京: 海洋出版社, 2004]
|
DE LA LUNA S, ALLEN K E, MASON S L, et al. Integration of a growth-suppressing BTB/POZ domain protein with the DP component of the E2F transcription factor. EMBO Journal, 1999, 18(1): 212-228 DOI:10.1093/emboj/18.1.212 |
DONG B, HUANG C, LI D, et al. Oct-1 functions as a transactivator in the hormonal induction of β-casein gene expression. Molecular and Cellular Biochemistry, 2009, 328(1/2): 93-99 |
HANNA L A, FOREMAN R K, TARASENKO I A, et al. Requirement for Foxd3 in maintaining pluripotent cells of the early mouse embryo. Genes and Development, 2002, 16(20): 2650-2661 DOI:10.1101/gad.1020502 |
INAMOTO S, SEGIL N, PAN Z Q, et al. The cyclin-dependent kinase-activating kinase (CAK) assembly factor, MAT1, targets and enhances CAK activity on the POU domains of octamer transcription factors. Journal of Biological Chemistry, 1997, 272(47): 29852-29858 DOI:10.1074/jbc.272.47.29852 |
JIANG J, ZHAO Z, PAN Y, et al. Gender specific differences of immune competence in the sea cucumber Apostichopus japonicus before and after spawning. Fish and Shellfish Immunology, 2019, 90: 73-79 DOI:10.1016/j.fsi.2019.04.051 |
JIANG J, ZHAO Z, PAN Y, et al. Proteomics reveals the gender differences in humoral immunity and physiological characteristics associated with reproduction in the sea cucumber Apostichopus japonicus. Journal of Proteomics, 2020, 217: 103687 DOI:10.1016/j.jprot.2020.103687 |
JIANG J, ZHOU Z, DONG Y, et al. Comparative analysis of immunocompetence between females and males in the sea cucumber Apostichopus japonicus. Fish and Shellfish Immunology, 2017, 63: 438-443 DOI:10.1016/j.fsi.2017.02.038 |
JONGENS T A, ACKERMAN L D, SWEDLOW J R, et al. Germ cell-less encodes a cell type-specific nuclear pore- associated protein and functions early in the germ-cell specification pathway of Drosophila. Genes and Development, 1994, 8(18): 2123-2136 DOI:10.1101/gad.8.18.2123 |
JONGENS T A, HAY B, JAN L Y, et al. The germ cell-less gene product: A posteriorly localized component necessary for germ cell development in Drosophila. Cell, 1992, 70(4): 569-584 DOI:10.1016/0092-8674(92)90427-E |
KIMURA T, ITO C, WATANABE S, et al. Mouse germ cell-less as an essential component for nuclear integrity. Molecular and Cellular Biology, 2003, 23(4): 1304-1315 DOI:10.1128/MCB.23.4.1304-1315.2003 |
KIMURA T, YOMOGIDA K, IWAI N, et al. Molecular cloning and genomic organization of mouse homologue of Drosophila germ cell-less and its expression in germ lineage cells. Biochemical and Biophysical Research Communications, 1999, 262(1): 223-230 DOI:10.1006/bbrc.1999.1160 |
LEATHERMAN J L, KAESTNER K H, JONGENS T A. Identification of a mouse germ cell-less homologue with conserved activity in Drosophila. Mechanisms of Development, 2000, 92(2): 145-153 DOI:10.1016/S0925-4773(99)00335-4 |
LI W Y, DENG F J, WANG H N, et al. Germ cell-less expression in zebrafish embryos. Development, Growth and Differentiation, 2006, 48(5): 333-338 DOI:10.1111/j.1440-169X.2006.00868.x |
NUMOTO M, NIWA O, KAPLAN J, et al. Transcriptional repressor ZF5 identifies a new conserved domain in zinc finger proteins. Nucleic Acids Research, 1993, 21(16): 3767-3775 DOI:10.1093/nar/21.16.3767 |
PUCCETTI E, SENNEWALD B, FOSCA-FERRARA F, et al. Down-stream regions of the POZ-domain influence the interaction of the t (11; 17)-associated PLZF/RARa fusion protein with the histone-deacetylase recruiting co-repressor complex. Hematology Journal, 2001, 2: 385-392 DOI:10.1038/sj.thj.6200138 |
RANGE R, LEPAGE T. Maternal Oct1/2 is required for Nodal and Vg1/Univin expression during dorsal-ventral axis specification in the sea urchin embryo. Developmental Biology, 2011, 357(2): 440-449 DOI:10.1016/j.ydbio.2011.07.005 |
SAMESHIMA T, YAMAMOTO T, SANO O, et al. Discovery of an irreversible and cell-active BCL6 inhibitor selectively targeting Cys53 located at the protein-protein interaction interface. Biochemistry, 2018, 57(8): 1369-1379 DOI:10.1021/acs.biochem.7b00732 |
SASAI N, MIZUSEKI K, SASAI Y. Requirement of FoxD3-class signaling for neural crest determination in Xenopus. 2001, 128: 2525-2536
|
SCHOLZ S, DOMASCHKE H, KANAMORI A, et al. Germ cell-less expression in medaka (Oryzias latipes). Molecular Reproduction and Development, 2004, 67(1): 15-18 DOI:10.1002/mrd.20012 |
SHAKYA A, KANG J, CHUMLEY J, et al. Oct1 is a switchable, bipotential stabilizer of repressed and inducible transcriptional states. Journal of Biological Chemistry, 2011, 286(1): 450-459 DOI:10.1074/jbc.M110.174045 |
STEWART R A, ARDUINI B L, BERGHMANS S, et al. Zebrafish foxd3 is selectively required for neural crest specification, migration and survival. Developmental Biology, 2006, 292(1): 174-188 DOI:10.1016/j.ydbio.2005.12.035 |
SUGAWARA M, SCHOLL T, PONATH P D, et al. A factor that regulates the class Ⅱ major histocompatibility complex gene DPA is a member of subfamily of zinc finger proteins that includes a Drosophila developmental control protein. Molecular and Cellular Biology, 1994, 14(12): 8438-8450 |
SUI X L, LIU Y X, LIU Y F, et al. A study on the reproductive cycle of sea cucumber. Journal of Fisheries of China, 1985, 9(4): 303-310 [隋锡林, 刘永襄, 刘永峰, 等. 刺参生殖周期的研究. 水产学报, 1985, 9(4): 303-310] |
SUN J J, SUN Z H, WEI J L, et al. Identification and functional analysis of foxl2 and nodal in sea cucumber, Apostichopus japonicus. Gene Expression Patterns, 2022, 44: 119245 DOI:10.1016/j.gep.2022.119245 |
SUN Z H, CUI Z P, SONG J, et al. Research progress on sex determination and sexual differentiation in Echinodermata: A review. Journal of Dalian Ocean University, 2021, 36(4): 679-686 [孙志惠, 崔洲平, 宋坚, 等. 棘皮动物性别决定与分化研究进展. 大连海洋大学学报, 2021, 36(4): 679-686 DOI:10.16535/j.cnki.dlhyxb.2020-195] |
SUN Z H, WEI J L, CUI Z P, et al. Identification and functional characterization of piwi1 gene in sea cucumber, Apostichopus japonicas. Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology, 2021, 252: 110536 DOI:10.1016/j.cbpb.2020.110536 |
YAN M, SUI J, SHAO M Y, et al. Histological observation on genesis and early differentiation of gonad in Apostichopus japonicas. Periodical of Ocean University of China (Natural Science), 2011, 41(5): 49-52 [晏萌, 隋娟, 邵明瑜, 等. 仿刺参生殖腺发生与早期分化的组织学观察. 中国海洋大学学报(自然科学版), 2011, 41(5): 49-52 DOI:10.16441/j.cnki.hdxb.2011.05.008] |
YAN M, SUI J, SHENG W, et al. Expression pattern of vasa in gonads of sea cucumber Apostichopus japonicus during gametogenesis and reproductive cycle. Gene Expression Patterns, 2013, 13(5/6): 171-176 |
ZHANG X, SUN L, YUAN J, et al. The sea cucumber genome provides insights into morphological evolution and visceral regeneration. PLoS Biology, 2017, 15(10): e2003790 DOI:10.1371/journal.pbio.2003790 |
ZHOU D X, YEN T S. The ubiquitous transcription factor Oct-1 and the liver-specific factor HNF-1 are both required to activate transcription of a hepatitis B virus promoter. Molecular and Cellular Biology, 1991, 11(3): 1353-1359 |



