海草是唯一一类可完全生活在海水中的被子植物,具有完整的根、茎、叶结构,主要分布于沿岸浅水区域,营沉水生活(Short et al, 2007; Lopez y Royo et al, 2011; 张沛东等, 2020)。构筑的海草床是滨海三大典型生态系统之一,具有极其重要的生态功能,不仅可为众多海洋生物提供栖息环境,还在净化水质、捕获沉积物、促进营养物质循环等海洋环境改善方面发挥重要作用(Jackson et al, 2001; Barbier et al, 2011; Christianen et al, 2013; Momota et al, 2022)。同时,海草床是最有效的碳封存系统之一,每年碳埋藏量达27.4 Tg C (Fourqurean et al, 2011)。然而,海草床为脆弱生态系统,受人类活动和全球气候变化的影响,全球绝大多数海草床均处于严重的日益衰退趋势,仅1993—2003年全球海草床已有2.6×106 hm2退化,并且下降速度在不断加快,约有14% (10种)的海草物种濒临灭绝(Waycott et al, 2009; Martins et al, 2005)。为防止海草床的继续退化和消失、促进其恢复,有关海草床生态恢复理论与技术的研究逐渐受到国内外学者的重视。植株移植法是迄今为止最成熟的修复方法,但其移植成本高、对供体海草床破坏大、劳动强度高(Fonseca et al, 1998; Goodman et al, 1995)。近年来,海草实生苗人工培育理论和技术逐渐成为研究热点。与自然海域海草实生苗建成率相比,人工培育的海草实生苗建成率可提高数倍至几十倍(Orth et al, 1994; Pickerell et al, 2005)。然而,目前的海草实生苗人工培育多采用将种子直接播种至基质中进行苗种建成,幼苗建成率较低(Wang et al, 2016; Churchill, 1992; Jarvis et al, 2015)。优化海草实生苗人工栽培技术、提高海草实生苗建成率是实现海草实生苗规模化培育的关键。
幼苗期是植物单株存活的决定性生活阶段,在植物生活周期中,种子萌发和幼苗期是植物生活史中最关键和最敏感的时期,在这个时期植物个体对生态因子的变化最敏感,个体损失率最高(Peterson et al, 2004)。海草实生苗的建成在很大程度上取决于水流、沉积物的稳定性、栽培基质和栽培方式(Kahn et al, 2005; Tanner et al, 2010; 程冉等, 2022)。栽培基质不仅可为植株根际提供固持作用,还可为植物提供营养元素和微量元素,从而促进植物快速生长(Short, 1987; Erftemeijer et al, 1994)。徐强(2016)开展了不同栽培基质(普通泥土、赤玉土、天鹅湖底泥和复合基质)对鳗草(Zostera marina)植株栽培效果影响的室内实验和海区实验,其研究结果均表明,普通泥土处理组的栽培效果最优,海区移植80 d后,普通泥土处理组的鳗草植株存活率最高(69%),是赤玉土处理组的3倍。
栽培方式也对海草实生苗建成具有显著影响。Wang等(2016)研究了基质栽培和无土栽培对鳗草种子萌发的影响,发现基质栽培处理组种子萌发率为46%,显著高于无土栽培处理组的种子萌发率(19%)。刘云龙等(2016)采用去离子水对鳗草种子进行促萌21 d,实生苗培育40 d,其种子萌发率达57%,但实生苗死亡率高达95%以上。谢坤秀(2021)研究了水培促萌+基质插植和基质栽培对鳗草实生苗建成的影响,发现水培促萌+基质插植处理组的实生苗建成率为49%,而基质栽培处理组的实生苗建成率仅为24%。由此可见,水培+萌中插植的鳗草实生苗的建成效果较好,但培育过程相比单纯的基质栽培需要更多人力,培育成本较高。因此,探究低成本、培育效果较好的鳗草实生苗栽培方式十分必要。
本研究以温带优势海草种类——鳗草为对象,于15 ℃、天然泥土基质条件下,研究了3种不同栽培方式(水培促萌+萌中插植、水培促萌+萌后插植和基质栽培)对鳗草种子萌发、实生苗建成和生理的影响,核算了3种不同栽培方式的培育成本,通过对比分析不同栽培方式下鳗草的实生苗建成、生长、生理指标及培育成本,得出鳗草实生苗适宜的栽培方式,查明鳗草种子及实生苗应对不同栽培方式的生理响应过程,以期为建立鳗草实生苗人工培育理论和技术提供参考。
1 材料与方法 1.1 实验材料鳗草种子于2021年7月采集于山东省荣成市天鹅湖(37.338 2°~37.358 8°N,122.555 1°~122.579 3°E)。在鳗草面积较大的区域通过人工方式收集生殖枝,将包含有种子的佛焰苞摘取置于尼龙网兜内,置于自然海域,待其成熟掉落于袋中并收集。收集好的种子置于室内低温无菌海水循环水槽中保存。
1.2 实验设计参考已有文献报道(Kahn et al, 2005; Tanner et al, 2010),并综合考虑插植时间、规模化培育和成本等因素,设置3种不同的栽培方式:水培促萌+萌中插植、水培促萌+萌后插植以及基质栽培,详情见表 1。每个处理组设置5个重复。根据谢坤秀(2021)、Niu等(2012)和Zhang等(2014)的研究结论,实验时长为42 d,其中,鳗草种子促萌12 d,鳗草实生苗室内培育30 d。
|
|
表 1 不同栽培方式处理设置 Tab.1 Treatment settings for different cultivation methods |
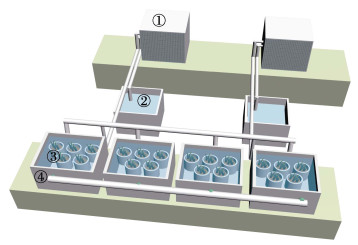
实生苗室内培育平台由4套循环系统组成,每套循环系统包括栽培容器、培育水箱、温度控制、循环水系统等设施,如图 1所示。栽培容器使用聚乙烯材质的圆形透明盒,规格为17 cm ×11.2 cm (直径×高),侧面开孔5个以利于基质与海水充分接触,开孔直径为1.2 cm,开口处表面积为1.1 cm2。室内培育水箱为聚乙烯材质,规格为90 cm × 60 cm×70 cm,每个培育水箱放置5个栽培容器。采用冷水机进行水温调控,并使用功率为200 W的水泵进行水体循环,以维持系统水温的均一性,循环速率为15 L/min。
|
图 1 实生苗室内培育平台模式图 Fig.1 Diagram of indoor seedling cultivation platform ①:温度控制系统;②:循环水系统;③:栽培容器;④:培育水箱 ①: Temperature control system; ②: Circulating water system; ③: Cultivation vessel; ④: Breeding water tank |
实验海水为马山集团有限公司自储海水,不同盐度人工海水通过海水与淡水按照一定比例混合调制。实验期间,保持海水温度为(15± 1) ℃,水深控制在(60±10) cm,为使盐度均衡,培育期间,每周换水1次。光照条件为自然光照,平均日光照强度为(3 321.17±120.15) lx。实验使用的栽培基质为采自马山集团有限公司的天然土壤。栽培基质与栽培容器之间放置医用无菌纱布,防止种子和基质流出。
1.4 实验过程将已消毒的1 500粒鳗草种子随机平均分成15份,每个处理组设置5个重复,每个重复100粒种子。每个处理组随机选择1套循环系统,包含的5个栽培容器(重复)随机放入其中的培育水箱,并每2 d随机调换位置。其中,水培促萌+萌中插植处理组再随机选择1套循环系统,用作萌发种子插植后的实生苗培育。
水培促萌+萌中插植处理组:促萌开始时,首先向已编号的各栽培容器中放入100粒种子,栽培容器顶部放置医用纱布,并用皮筋固定,防止种子外溢;然后将其置于培育水箱,加入淡水至60 cm促萌4 d,结束后将淡水全部排出并加入盐度为10的人工海水继续促萌8 d;促萌期间,将已萌发的种子(以子叶≥1 cm为萌发标志)挑出,分别插植到对应编号的装有栽培基质的栽培容器中,插植时小心地将幼苗下胚轴插入基质,至基质覆盖下胚轴;然后将其置于随机选择的另外1套循环系统的培育水箱,加入盐度为20的人工海水至60 cm进行实生苗培育。
水培促萌+萌后插植处理组:促萌阶段与水培促萌+萌中插植处理组相同,但促萌期间不将萌发种子挑出,直至促萌阶段(12 d)结束,统一将萌发的种子插植到对应编号的装有栽培基质的栽培容器中,然后放回原培育水箱,排出促萌期间使用的人工海水,加入盐度为20的人工海水至60 cm进行实生苗培育。
基质栽培处理组:首先将种子均匀播种至装有栽培基质的栽培容器中,播种深度距基质表面1.5~2 cm,然后置于培育水箱,加入淡水至60 cm促萌4 d,结束后将淡水全部排出并加入盐度为10的人工海水至60 cm继续促萌8 d,促萌阶段共计12 d。促萌阶段结束后,将盐度为10的海水全部排出并加入盐度为20的人工海水至60 cm进行实生苗培育。
1.5 样品采集与分析促萌结束后,统计各处理组种子萌发数,计算种子累积萌发率。室内培育结束后,统计各处理组实生苗数,计算各处理组实生苗建成率;测定实生苗的株高、叶长、叶宽和根长等生长指标,并随机选取5株实生苗,使用去离子水清洗后置于60 ℃烘干至恒重,测定实生苗生产力;随后在每个处理组选取15株幼苗用于可溶性糖和淀粉含量的测定(蒽酮法)、光合色素含量的测定(萃取法)和总碳、总氮含量的测定(Lewis et al, 2007; 王文杰等, 2009)。
| $ \text { 累积萌发率 }(\%)=\sum n_i / N \times 100$ | (1) |
式中,ni为第i天种子的萌发数,N为萌发种子的总数;
| $\text { 实生苗建成率 }(\%)=\text { 存活的幼苗数 } / \text { 初始种子数 } \times 100 $ | (2) |
| $ \text { 地上组织绝对生长速率(mm/d)=株高/幼苗培育时间} $ | (3) |
| $ \text { 叶片延伸速率(mm/d)=每株实生苗叶片长度之和/实生苗培育时间 } $ | (4) |
| $ 单株叶面积(\text {cm}^{2}/\text {shoot})=每株实生苗叶片面积之和$ | (5) |
| $ \text { 根延伸速率(mm/d)=每株实生苗最大根长/实生苗培育时间} $ | (6) |
| $ \text { 根生成率 }[\operatorname{roots} /(\text { shoot·d)] }=每株实生苗根数之和/实生苗培育时间 $ | (7) |
| $ \text { 生产力 }[\mathrm{mg} \;\mathrm{DW} /(\text { shoot-d)] }=每株实生苗干重/实生苗培育时间 $ | (8) |
鳗草实生苗的培育成本(元/株)=培育费用/实生苗数量。培育费用主要包括种子费、材料费(循环水、栽培基质和栽培容器等费用)、能源费(培育水体循环和制冷等费用)和人工费(基质填充、日常维护和基质插植等费用)。本研究基于1个重复(100粒种子)进行了培育费用估算,如表 2所示,并根据各重复的实生苗数量,最终计算得出各重复的培育成本。
|
|
表 2 培育费用分析1/元 Tab.2 Cultivation costs analysis/Yuan |
运用SPSS 25.0软件对数据进行分析,不同栽培方式处理组的实生苗指标采用单因素方差分析(one-way ANOVA),若存在显著差异再使用Duncan´s分析进行多重比较。显著性水平设置为P < 0.05。采用R语言绘制PCA,筛选不同栽培方式影响鳗草实生苗的主要成分指标。采用R语言对数据进行Pearson相关性分析,同时,对生理指标与生长指标进行Mantel相关性分析,探究实生苗各指标之间的相关性水平。实验数据采用平均值±标准误(Mean±SE)表示。
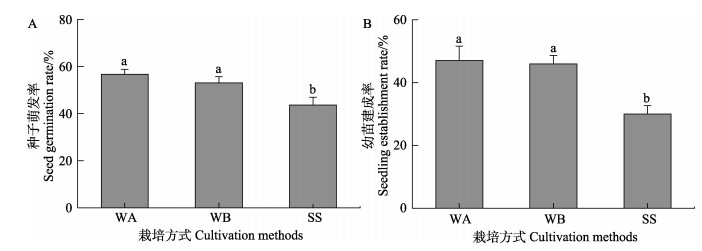
2 结果 2.1 种子萌发率和实生苗建成率不同栽培方式的鳗草种子萌发率和实生苗建成率存在显著差异(图 2)。其中,水培促萌+萌中插植处理组种子萌发率和实生苗建成率最高(57%和47%),分别是基质栽培处理组的1.3倍和1.6倍(P < 0.05)。
|
图 2 不同栽培方式对鳗草种子萌发(A)和实生苗建成(B)的影响 Fig.2 The effect of different cultivation methods on the seed germination (A) and seedling establishment (B) of eelgrass WA:水培促萌+萌中插植处理组;WB:水培促萌+萌后插植处理组;SS:基质栽培方式处理组。误差线上不同字母表示不同处理之间存在显著差异(P < 0.05)。下同。 WA: Hydroponic germination promotion + germination insertion treatment; WB: Hydroponic germination promotion + germination post-insertion treatment; SS: Substrate cultivation treatment. Different letters on the error bar indicate significant differences between treatments (P < 0.05). The same below. |
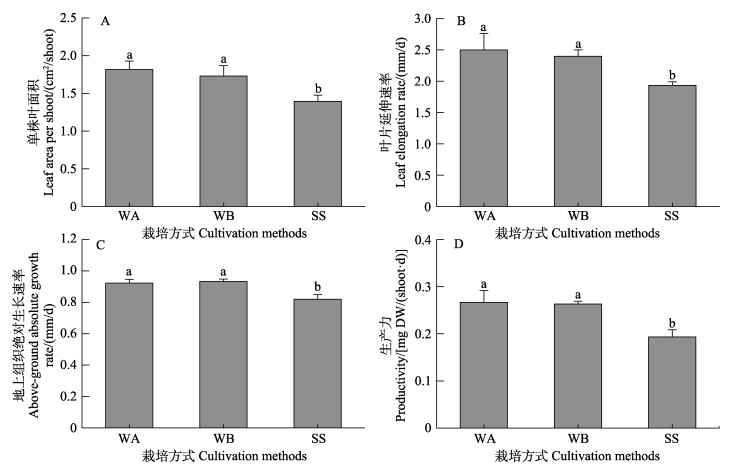
单因素方差分析显示,不同栽培方式对鳗草实生苗地上组织指标存在显著差异(P < 0.05),如图 3所示。水培促萌+基质插植处理实生苗的形态规格均较大,其中,水培促萌+萌中插植处理组各地上组织指标均最高,其单株叶面积、叶片延伸速率、地上部分绝对生长速率和实生苗生产力是基质栽培方式处理组的1.1~1.4倍(P < 0.05)。
|
图 3 不同栽培方式对实生苗单株叶面积(A)、叶片延伸速率(B)、地上组织绝对生长速率(C)和实生苗生产力(D)的影响 Fig.3 The effect of different cultivation methods on the leaf area per shoot (A), leaf elongation rate (B), above-ground absolute growth rate (C) and productivity (D) of eelgrass |
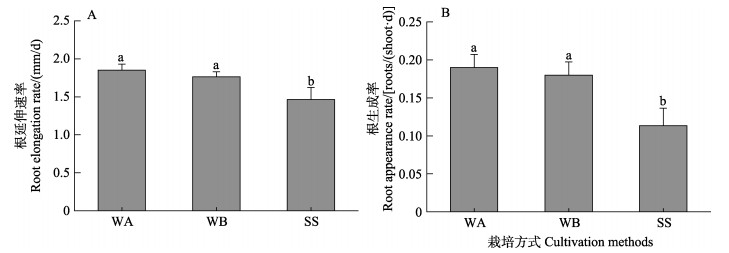
不同栽培方式对鳗草实生苗地下组织具有显著影响,其中,以基质栽培方式处理组最低,如图 4所示。单因素方差分析显示,基质栽培方式处理组鳗草实生苗的根延伸速率和根生成率仅为水培促萌+萌中插植处理组的79.0%和59.6% (P < 0.05)。
|
图 4 不同栽培方式对根延伸速率(A)和根生成率(B)的影响 Fig.4 The effect of different cultivation methods on the root elongation rate (A) and root generation rate (B) of eelgrass |
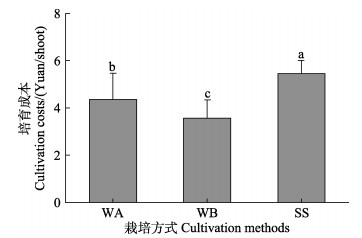
单因素方差分析结果显示,不同栽培方式对培育成本具有显著影响(P < 0.05),如图 5所示。水培促萌+萌后插植处理组单株培育成本最低(3.6元/株),分别是水培促萌+萌中插植和基质栽培方式培育成本的81.9%和65.6%。
|
图 5 不同栽培方式对培育成本的影响 Fig.5 The effect of different cultivation methods on cultivation costs |
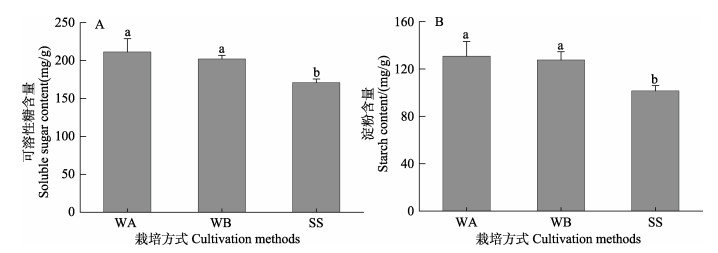
单因素方差分析结果显示,水培促萌+萌中插植和水培促萌+萌后插植的可溶性糖含量和淀粉含量无显著差异(P > 0.05),但均显著高于基质栽培方式处理组(P < 0.05)(图 6)。基质栽培方式处理组可溶性糖含量和淀粉含量相比水培促萌+萌中插植处理组降低19.1%和22.4%。
|
图 6 不同栽培方式对可溶性糖含量(A)和淀粉含量(B)的影响 Fig.6 The effect of different cultivation methods on the soluble sugar content (A) and starch content (B) of eelgrass |
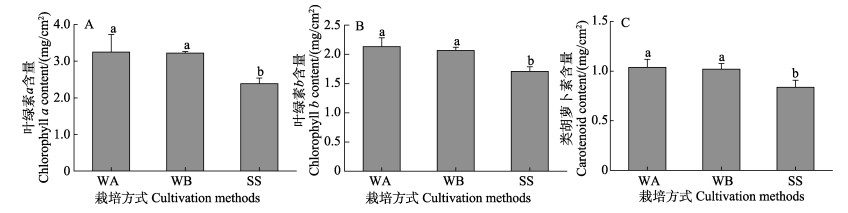
室内培育结束后,各栽培方式处理组叶绿素a含量在2.4~3.2 mg/cm2之间,叶绿素b含量相比在1.7~2.1 mg/cm2之间,类胡萝卜素含量在0.8~1.0 mg/cm2之间(图 7)。其中,水培促萌+萌中插植处理组实生苗光合色素含量显著高于基质栽培方式处理组,水培促萌+萌中插植处理组叶绿素a含量、叶绿素b含量和类胡萝卜素含量分别是基质栽培方式处理组的1.4、1.2和1.2倍(P < 0.05)。
|
图 7 不同栽培方式对叶绿素a含量(A)、叶绿素b含量(B)和类胡萝卜素含量(C)的影响 Fig.7 The effect of different cultivation methods on the chlorophyll a content (A), chlorophyll b content (B) and carotenoid content (C) of eelgrass |
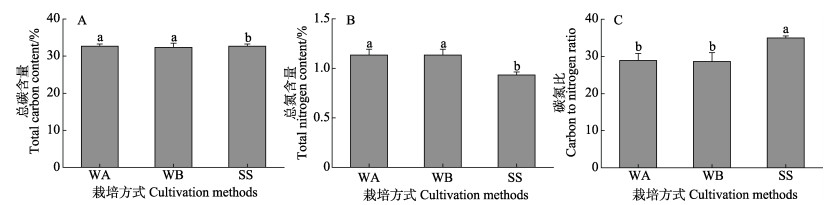
各栽培方式处理组实生苗的总碳含量均高于32% (图 8),各栽培方式处理组实生苗总碳含量无显著差异(P > 0.05)。各栽培方式处理组总氮含量均较低,在0.93%~1.13%之间。其中,水培促萌+萌中插植处理组总氮含量最高,是最低值的1.2倍(P < 0.05)。不同栽培方式处理组实生苗的碳氮比在28.6~35.0之间,基质栽培方式处理组碳氮比最高,达到35.0,是其他处理组的1.2倍(P < 0.05)。
|
图 8 不同栽培方式处理对总碳(A)、总氮(B)和碳氮比(C)的影响 Fig.8 The effect of different cultivation methods on the total carbon (A), total nitrogen (B) and C/N ratio (C) of eelgrass |
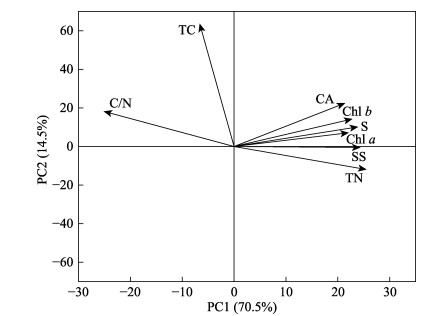
对不同栽培方式实生苗的生理指标进行主成分分析。结果显示,前4个排序轴对实生苗生理各指标解释量为70.5%、14.5%、7.9%和4.6%,第1、第2排序轴累积方差解释率为85%,前2个主成分(Dim.1和Dim.2)的特征值大于1,占特征值的80%以上(见表 3)。
|
|
表 3 PCA分析相关解释量 Tab.3 Related explanatory quantities of PCA |
每个变量对两成分的相关性显示,总氮含量对主成分1的贡献最大,碳氮比和可溶性糖含量对主成分1的贡献较大,除总碳含量和碳氮比外,各指标均与主成分1呈正相关(图 9)。将8个指标进行排序,综合结果显示WA > WB > SS,因此,3个实验组中,WA(水培促萌+萌中插植处理组)对鳗草实生苗生长的促进效果最优。
|
图 9 不同栽培方式处理组与植株生理指标的PCA排序图 Fig.9 PCA sequence diagram of different cultivation treatments and plant physiological indicators CA:类胡萝卜素;Chl a:叶绿素a;Chl b:叶绿素b;TN:总氮;TC:总碳;C/N:碳氮比;SS:可溶性糖;S:淀粉。下同。 CA: Carotenoids, Chl a: Chlorophyll a, Chl b: Chlorophyll b, TN: Total nitrogen, TC: Total carbon, C/N: Carbon nitrogen ratio, SS: Soluble sugar, S: Starch. The same below. |
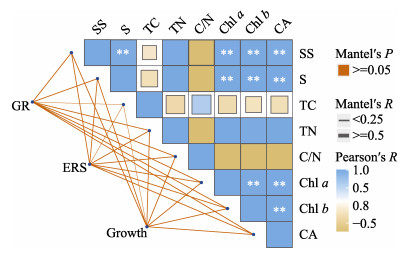
对鳗草实生苗生理指标采用Pearson相关性分析,萌发建成、生长指标与生理指标之间采用Mantel相关性分析,如图 10所示。可溶性糖含量与光合色素(Chl a、Chl b和CA)呈显著正相关(Cor > 0.8, P < 0.05),淀粉含量与光合色素呈显著正相关(Cor > 0.8, P < 0.05)。表明适宜的栽培方式主要通过提升实生苗非结构性碳水化合物的形成和光合色素含量,加快实生苗可溶性糖和淀粉含量生成,实现对实生苗建成生长的促进作用。
|
图 10 鳗草实生苗萌发建成、生长指标和生理指标相关性分析 Fig.10 Correlation analysis of germination, growth and physiological indicators of eelgrass seedlings |
不同栽培方式能影响植株所处的生态环境、生长发育和物质的积累与分配,从而影响植株的建成和生长等(Zhang et al, 2015; 江鑫等, 2012; Ochieng et al, 2010; Dennison et al, 1993)。本研究发现,水培促萌+萌中插植、水培促萌+萌后插植的栽培方式显著提升了鳗草的实生苗建成率,这2种栽培方式的实生苗建成率是基质栽培方式的1.6倍。这可能是因为水培促萌的方式可使种子与低盐度水体充分接触,休眠破除速度快,种子萌发率和实生苗建成率均较高,而基质栽培方式可能降低了种子与低盐度水体的接触度,导致其休眠破除速度慢,种子萌发率和实生苗建成率降低。
Churchill (1992)研究发现,子叶提供幼苗存活所必须的O2,子叶能否突破沉积物是实生苗建成和存活的关键。海草实生苗人工培育中,埋藏较深的种子比埋得较浅的种子需要更长的下胚轴,导致幼苗子叶从沉积物表面出现之前需要更长的时间,子叶出现的任何延迟都可能导致幼苗死亡。Granger等(2000)发现,鳗草种子播种深度为2 cm的萌发率和实生苗存活率显著高于播撒于基质表面和播种更深的种子。Churchill(1992)发现,播种深度为1 cm的鳗草种子萌发率显著高于播种深度大于3 cm,且随着深度增加,在实验结束时因腐烂损失的种子越多。本研究中,水培促萌+萌中插植、水培促萌+萌后插植栽培方式处理可以减少因子叶突破沉积物所需的能量消耗,使种胚中储存的能量更多流向实生苗建成和生长发育,提高了实生幼苗的建成率。
本研究中,水培促萌+萌中插植、水培促萌+萌后插植处理组不仅减少了子叶因突破沉积物所需的能量消耗,而且在种子萌发后通过即时变盐处理培养,实现实生苗高建成率(46.5%)。刘云龙等(2016)在实验室条件下进行鳗草实生苗培育,发现鳗草种子经盐度0萌发培养21 d,再转入盐度15继续培育,鳗草实生苗建成率达24.4%,高于同期在盐度30储存的鳗草种子自然萌发率(0.2%)。本研究结果与刘云龙等(2016)的结论相一致。Hootsmans等(1987)发现,低盐度中鳗草种子存活和发育能力均减弱,种子萌发后的发育和存活决定实生苗建成率,同样受到盐度的限制。同时,有研究发现,鳗草实生苗适宜的存活盐度为5~42,低盐度会加剧鳗草实生苗的死亡(Phillips et al, 1983; Giesen et al, 1990; Arasaki et al, 1950)。
3.2 不同栽培方式对海草实生苗生理状况的影响植物的生长发育是以其生理响应作为物质基础,特别是有关栽培方式与非结构性碳水化合物等物质代谢的生理过程(江志坚等, 2012)。本研究发现,水培促萌+萌中插植、水培促萌+萌后插植处理组叶绿素a含量和叶绿素b含量均显著高于基质栽培方式处理组,平均分别是其1.4和1.2倍。谢坤秀(2021)研究了不同栽培方式对鳗草实生苗培育效果的影响,发现水培促萌+萌中插植栽培方式下鳗草实生苗光合电子传递速率达47,是基质栽培方式处理组的1.3倍。本研究结果与谢坤秀(2021)的结论一致。这可能是种子萌发后迅速插植至基质中进行培育,减少了低盐度对实生苗造成的损伤。Arasaki (1950)发现,低盐度会损害海草实生苗的生长,鳗草实生苗的盐度下限为5~7。同时,鳗草实生苗在低盐环境下生长和光合作用都会受到限制(Pinnerup, 1980)。Hellblom等(1999)发现,鳗草幼苗光合作用随盐度升高而增强。
海草能将其叶光合作用产物——非结构性碳水化合物(如葡萄糖、蔗糖和淀粉等)储存起来,而这些碳水化合物在其叶和根茎中的含量将随着光照、水温等环境因子而变化(Ochieng et al, 2010; Dennison et al, 1993)。Niu等(2012)在实验室条件下进行鳗草实生幼苗的培育,发现种子在水培条件下促萌并将萌发幼苗移至细沙基质中培养,幼苗叶绿素a含量高达7.0 mg/g。本研究表明,鳗草实生苗可溶性糖含量、可溶性淀粉含量与光合色素之间呈极显著正相关,基质栽培方式下鳗草实生苗形态学指标均较低,光合能力弱。而水培促萌+萌中插植、水培促萌+萌后插植栽培方式下,鳗草实生苗生长较快,光合能力强,营养物质积累多,生产力平均达0.27 mg DW/(shoot·day)。
4 结论本研究分析了天然泥土基质条件下,水培促萌+萌中插植、水培促萌+萌后插植和基质栽培3种栽培方式对鳗草种子萌发、实生苗建成及生理响应过程的影响,核算了3种不同栽培方式的培育成本。综合实生苗培育效果和培育成本发现,水培促萌+萌后插植栽培方式展现出最优的培育效果和培育成本,其实生苗建成率达到46%,是基质栽培方式处理的1.5倍,且培育成本为3.6元/株,较水培促萌+萌中插植降低了18.1%。研究结果为丰富海草生物学理论、建立低成本且高效的鳗草实生苗人工培育技术等提供了基础数据。利用海草种子人工育苗后移栽到海区的修复方式逐渐成为热点,关于不同栽培方式与陆海接力修复模式对鳗草实生苗建成和生长的影响是否存在交互作用等科学问题,还需进一步探讨。
ARASAKI S. Studies on the ecology of Zostera marina and Zostera nana. Bulletin of the Japanese Society of Scientific Fisheries, 1950, 16(2): 70-76 DOI:10.2331/suisan.16.70 |
BARBIER E B, HACKER S D, KENNEDY C, et al. The value of estuarine and coastal ecosystem services. Ecological Monographs, 2011, 81(2): 169-193 DOI:10.1890/10-1510.1 |
CHENG R, HOU X, WANG H, et al. Survival, growth, and physiological responses of surfgrass transplants to different hydrodynamic regimes. Progress in Fishery Sciences, 2022, 43(2): 21-31 [程冉, 侯鑫, 王欢, 等. 红纤维虾形草移植植株存活、生长和生理对不同水动力条件的响应. 渔业科学进展, 2022, 43(2): 101-104 DOI:10.19663/j.issn2095-9869.20201227001] |
CHRISTIANEN M J A, VAN BELZEN J, HERMAN P M J, et al. Low-canopy seagrass beds still provide important coastal protection services. PLoS One, 2013, 8(5): e62413 DOI:10.1371/journal.pone.0062413 |
CHURCHILL A C. Growth characteristics of Zostera marina seedlings under anaerobic conditions. Aquatic Botany, 1992, 43(4): 379-392 DOI:10.1016/0304-3770(92)90049-O |
DENNISON W C, ORTH R J, MOORE K A, et al. Assessing water quality with submersed aquatic vegetation. BioScience, 1993, 43(2): 86-94 DOI:10.2307/1311969 |
ERFTEMEIJER P L A, STAPEL J, SMEKENS M J E, et al. The limited effect of in situ phosphorus and nitrogen additions to seagrass beds on carbonate and terrigenous sediments in South Sulawesi, Indonesia. Journal of Experimental Marine Biology & Ecology, 1994, 182(1): 123-140 |
FONSECA M S, KENWORTHY W J, THAYER G W. Guidelines for the conservation and restoration of seagrasses in the United States and adjacent waters. Marine Ecology Progress, 1998
|
FOURQUREAN J W, DUARTE C M, KENNEDY H, et al. Seagrass ecosystems as a globally significant carbon stock. Nature Geoscience, 2012, 5(7): 505-509 DOI:10.1038/ngeo1477 |
GIESEN W B J T, VAN KATWIJK M M, DEN HARTOG C. Eelgrass condition and turbidity in the Dutch Wadden Sea. Aquatic Botany, 1990, 37(1): 71-85 DOI:10.1016/0304-3770(90)90065-S |
GOODMAN J L, MOORE K A, DENNISON W C. Photosynthetic responses of eelgrass (Zostera marina L.) to light and sediment sulfide in a shallow barrier island lagoon. Aquatic Botany, 1995, 50(1): 37-47 DOI:10.1016/0304-3770(94)00444-Q |
GRANGER S L, TRABER M S, NIXON S W. The influence of planting depth and density on germination and development of Zostera marina seeds. Biologia Marina Mediterranea, 2000, 7(3): 55-58 |
HELLBLOM F, BJORK M. Photosynthetic responses in Zostera marina to decreasing salinity, inorganic carbon content and osmolality. Aquatic Botany, 1999, 65(1/2/3/4): 97-104 |
HOOTSMANS M J M, VERMAAT J E, VAN VIERSSEN W. Seed-bank development, germination and early seedling survival of two seagrass species from the Netherlands: Zostera marina L. and Zostera noltii hornem. Aquatic Botany, 1987, 28(3/4): 275-285 |
JACKSON E L, ROWDEN A A, ATTRILL M J, et al. The importance of seagrass beds as a habitat for fishery species. Oceanography and Marine Biology, 2001, 39: 269-304 |
JARVIS J C, MOORE K A. Effects of seed source, sediment type, and burial depth on mixed-annual and perennial Zostera marina L. seed germination and seedling establishment. Estuaries and Coasts, 2015, 38(3): 964-978 DOI:10.1007/s12237-014-9869-3 |
JIANG X, PAN J H, HAN H W, et al. Effects of substrate and water depth on distribution of sea weeds Zostera marina and Z. caespitosa. Journal of Dalian Ocean University, 2012, 27(2): 101-104 [江鑫, 潘金华, 韩厚伟, 等. 底质与水深对大叶藻和丛生大叶藻分布的影响. 大连海洋大学学报, 2012, 27(2): 101-104 DOI:10.3969/j.issn.1000-9957.2012.02.002] |
JIANG Z J, HUANG X P, ZHANG J P. Effect of environmental stress on non-structural carbohydrates reserves and transfer in seagrasses. Acta Ecologica Sinica, 2012, 32(19): 6242-6250 [江志坚, 黄小平, 张景平. 环境胁迫对海草非结构性碳水化合物储存和转移的影响. 生态学报, 2012, 32(19): 6242-6250] |
KAHN A E, DURAKO M J. The effect of salinity and ammonium on seed germination in Ruppia maritima from Florida Bay. Bulletin of Marine Science, 2005, 77(3): 453-458 |
LEWIS M A, DANTIN D D, CHANCY C A, et al. Florida seagrass habitat evaluation: A comparative survey for chemical quality. Environmental Pollution, 2007, 146(1): 206-218 DOI:10.1016/j.envpol.2006.04.041 |
LIU Y L, ZHANG X L. The effects of salinity on seed germination and seedling development of the seagrass, Zostera marina L. Haiyang Xuebao, 2016, 38(2): 104-111 [刘云龙, 张学雷. 盐度对大叶藻种子萌发和幼苗发育的影响. 海洋学报, 2016, 38(2): 104-111] |
LOPEZ Y ROYO C, PERGENT G, ALCOVERRO T, et al. The seagrass Posidonia oceanica as indicator of coastal water quality: Experimental intercalibration of classification systems. Ecological Indicators, 2011, 11(2): 557-563 DOI:10.1016/j.ecolind.2010.07.012 |
MARTINS I, NETO J M, FONTES M G, et al. Seasonal variation in short-term survival of Zostera noltii transplants in a declining meadow in Portugal. Aquatic Botany, 2005, 82(2): 132-142 DOI:10.1016/j.aquabot.2005.03.006 |
MOMOTA K, HOSOKAWA S, KOMURO T. Small-scale heterogeneity of fish diversity evaluated by environmental DNA analysis in eelgrass beds. Marine Ecology Progress Series, 2022, 688: 99-112 DOI:10.3354/meps13994 |
NIU S N, ZHANG P D, LIU J, et al. The effect of temperature on the survival, growth, photosynthesis, and respiration of young seedlings of eelgrass Zostera marina L. Aquaculture, 2012, 350: 98-108 |
OCHIENG C A, SHORT F T, WALKER D I. Photosynthetic and morphological responses of eelgrass (Zostera marina L.) to a gradient of light conditions. Journal of Experimental Marine Biology and Ecology, 2010, 382(2): 117-124 DOI:10.1016/j.jembe.2009.11.007 |
ORTH R J, LUCKENBACH M, MOORE K A. Seed dispersal in a marine macrophyte: Implications for colonization and restoration. Ecology, 1994, 75(7): 1927-1939 DOI:10.2307/1941597 |
PETERSON J E, BALDWIN A H. Seedling emergence from seed banks of tidal freshwater wetlands: Response to inundation and sedimentation. Aquatic Botany, 2004, 78(3): 243-254 DOI:10.1016/j.aquabot.2003.10.005 |
PHILLIPS R C, STEWART G W, PETER M C. Reproductive strategies of eelgrass (Zostera marina L.). Aquatic Botany, 1983, 16(1): 1-20 |
PICKERELL C H, SCHOTT S, WYLLIE-ECHEVERRIA S. Buoy-deployed seeding: Demonstration of a new eelgrass (Zostera marina L.) planting method. Ecological Engineering, 2005, 25(2): 127-136 |
PINNERUP S P. Leaf production of Zostera marina L. at different salinities. Ophelia, 1980, 1(Suppl): 219-224 |
SHORT F T. Effects of sediment nutrients on seagrasses: Literature review and mesocosm experiment. Aquatic Botany, 1987, 27(1): 41-57 |
SHORT F, CARRUTHERS T, DENNISON W, et al. Global seagrass distribution and diversity: A bioregional model. Journal of Experimental Marine Biology and Ecology, 2007, 350(1/2): 3-20 |
TANNER C E, PARHAM T. Growing Zostera marina (eelgrass) from seeds in land-based culture systems for use in restoration projects. Restoration Ecology, 2010, 18(4): 527-537 |
WANG M, WANG Y, GUO X, et al. Reproductive properties of Zostera marina and effects of sediment type and burial depth on seed germination and seedling establishment. Aquatic Botany, 2016, 134: 68-74 |
WANG W J, HE H S, GUAN Y, et al. Methodological comparison of chlorophyll and carotenoids contents of plant species measured by DMSO and acetone-extraction methods. Bulletin of Botanical Research, 2009, 29(2): 224-229 [王文杰, 贺海升, 关宇, 等. 丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较. 植物研究, 2009, 29(2): 224-229] |
WAYCOTT M, DUARTE C M, CARRUTHERS T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381 |
XIE K X. Physiological and ecological effects of salinity and cultivation methods on the establishment of Zostera marina seedlings. Masterxs Thesis of Ocean University of China, 2021 [谢坤秀. 盐度及栽培方式对鳗草实生苗建成影响的生理生态学研究. 中国海洋大学硕士研究生学位论文, 2021]
|
XU Q. Studies on culture substrate and transplanting eelgrass with rhizome substrate envelopes of Zostera marina L. Masterxs Thesis of Ocean University of China, 2016 [徐强. 大叶藻植株栽培基质及根状茎基质包裹移植方法的研究. 中国海洋大学硕士研究生学位论文, 2016]
|
ZHANG P D, ZHANG L Y, NIU S N, et al. Effect of light intensity on survival, growth, and photosynthetic pigment of young seedlings of eelgrass Zostera marina Linnaeus, 1753 (Alismatales: Zosteraceae). Marine Biology Research, 2014, 10(8): 745-754 |
ZHANG P D, ZHANG Y H, ZHANG H Y, et al. Research advances in shoot propagation theory and planting technique of Seagrasses. Progress in Fishery Sciences, 2020, 41(4): 181-189 [张沛东, 张彦浩, 张宏瑜, 等. 海草植株扩繁理论及其定植效应的研究进展. 渔业科学进展, 2020, 41(4): 181-189] |
ZHANG Q, LIU J, ZHANG P D, et al. Effect of silt and clay percentage in sediment on the survival and growth of eelgrass Zostera marina: Transplantation experiment in Swan Lake on the eastern coast of Shandong Peninsula, China. Aquatic Botany, 2015, 122: 15-19 |



