2. 海洋生物学与生物技术功能实验室 山东 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 福州市海洋与渔业技术中心 福建 福州 350005
2. Laboratory for Marine Biology and Biotechnology, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Oceanic & Fishery Technology Center of Fuzhou, Fuzhou 350005, China
在脊椎动物中,胰岛素超家族由胰岛素(insulin)、胰岛素样生长因子(insulin-like growth factor, IGF)、松弛素(relaxin)等成员组成,它们在结构上高度保守,均具有N端信号肽、B链、C肽和A链;在功能上,这些分子通过与细胞膜上的受体结合激活胰岛素信号通路,从而调节生物新陈代谢、生长发育、繁殖与寿命等关键生理过程(Hoffmann et al, 2011)。目前,在无脊椎动物中未发现胰岛素或IGF,但在果蝇(Drosophila melanogaster) (Riehle et al, 2006)、埃及伊蚊(Aedes aegypti) (Liu et al, 2016)、东澳岩龙虾(Sagmariasus verreauxi) (Chandler et al, 2017)、秀丽隐杆线虫(Caenorhabditis elegans) (Zheng et al, 2018)、紫球海胆(Strongylocentrotus purpuratus) (Perillo et al, 2014)、澳大利亚斑点海葵(Oulactis sp.) (Mitchell et al, 2021)等物种中发现了多种胰岛素的类似物——类胰岛素肽(insulin-like peptides, ILPs),这些ILP都具有胰岛素超家族保守的结构特征与功能,表明ILP是一个古老的胰岛素超家族成员。
昆虫ILP主要由大脑的神经分泌细胞产生,功能上比脊椎动物胰岛素更加广泛和复杂,在调控代谢、生长、变态、繁殖、免疫、蜕皮和昼夜节律等方面发挥重要作用(Wu et al, 2006)。例如,在长红锥蝽(Rhodnius prolixus)和柞蚕(Antheraea pernyi)中,ILP基因的表达能够调节碳水化合物代谢和海藻糖代谢(Li et al, 2021; Haddad et al, 2022);在果蝇中过表达DILP1可以促进蛹期器官组织的生长(Liao et al, 2020);在马铃薯甲虫(Leptinotarsa decemlineata)中干扰LdILP表达会导致成蛹时间延长(Fu et al, 2016);在柑桔木虱(Diaphorina citri)中干扰DcILP1和DcILP2表达会导致产卵数量显著减少,且卵巢空泡化使其发育受到极大的抑制(Wang et al, 2022);在蓖麻蚕(Samia cynthia ricini)中ScILP能够刺激促前胸腺激素(Prothoracicotropic hormone, PTTH)的活性,从而进一步调控蜕皮激素(20-hydroxyecdysone, 20E)的合成与释放(Nagata et al, 1999);而在果蝇中敲除DILP5会严重影响昼夜节律的周期(Yamaguchi et al, 2022)。
甲壳动物中ILP基因的相关研究较少。已有的研究结果显示,ILP主要在脑、眼柄、性腺和触角腺等组织中表达(Chandler et al, 2017; Jiang et al, 2020)。在功能方面,ILP参与调控代谢、生长、免疫和生物与环境相互作用等生命活动。例如,在凡纳滨对虾(Litopenaeus vannamei)和中华绒螯蟹(Eriocheir sinensisis)中过表达LvILP1能够降低血淋巴中葡萄糖的含量(Su et al, 2022; Wang et al, 2020);罗氏沼虾(Macrobrachium rosenbergii)中干扰ILP表达能够降低肝胰腺中海藻糖和糖原水平(Jiang et al, 2020);在日本沼虾(Macrobrachium nipponense)中干扰ILP表达显著减缓了其生长速度(Li et al, 2019);中华绒螯蟹中EsILP在眼柄和血细胞中高表达以参与机体对嗜水气单胞菌(Aeromonas hydrophila)感染的免疫反应(Wang et al, 2020);而在飞马哲水蚤(Calanus finmarchicus)中鉴定出4种CfILP前体,研究发现,其可能参与控制生物体与环境的相互作用,例如季节性亚成体滞育的调节(Christie et al, 2016)。
凡纳滨对虾因具有生长快、出肉率高、抗病性强、耐粗饲料等诸多优点,已成为我国和世界上最具经济价值的水产养殖虾类。作为重要的水产经济物种,其生长性状的遗传学基础一直倍受关注(方振朋等, 2020; 刘峻宇等, 2021)。在最近的研究中,本课题组鉴定了凡纳滨对虾胰岛素信号通路中的一些重要基因,如胰岛素受体(insulin receptors, InRs)、胰岛素样生长因子结合蛋白(insulin-like growth factor binding proteins, IGFBPs),以及通路下游的磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase, PI3K)、叉头框蛋白O (forkhead box O, FoxO)、糖原合成酶激酶-3 (glycogen synthase kinase-3, GSK3)等基因,初步的功能研究显示,干扰这些基因的表达会影响对虾的生长速度(Pang et al, 2021a、b),由此确认对虾中存在胰岛素信号通路,该通路可以调控虾类的生长。而作为激活该信号通路的开关分子ILP,其基因结构、系统进化以及分子功能尚不清楚。本研究从凡纳滨对虾转录组数据中鉴定出一条ILP基因,通过生物信息学分析方法预测其结构、系统进化、转录因子、互作蛋白等,并通过实时荧光定量PCR (RT-qPCR)检测该基因在各组织中的相对表达量,这些研究结果可为后续对虾ILP的结构与功能研究及筛选胰岛素信号通路基因作为分子遗传育种的靶点提供基础。
1 材料与方法 1.1 实验材料本实验所用的凡纳滨对虾来自山东日照养殖基地,在中国科学院海洋研究所(山东青岛)的水族楼中养殖至少1周以稳定其生存状态。养殖海水清洁无菌,氧气充足,温度为(25.0±0.2) ℃,盐度为30,pH值为7.5±0.1。每日09:00、15:00和21:00分别使用颗粒饲料(烟台大乐饲料公司)喂食一次,每日更换一次养殖海水。
1.2 组织采集选取9尾健康雌性对虾,体长为(6.7±0.8) cm,体重为(4.5±0.7) g。取样组织为眼柄、卵巢、表皮、肌肉、胃、脑、肠、鳃、肝胰腺、腹神经、血细胞、胸神经节、淋巴器官和心脏,共计14种组织。将每3尾虾的相同组织混为1个样品(确保样品量足够后续分析),共取3个生物学重复。取样完成后,将样品迅速放入液氮中冷冻,最后将所有样品放置–80 ℃超低温冰箱储存。
1.3 实验方法 1.3.1 LvILP1基因序列鉴定从本实验室前期获得的凡纳滨对虾基因组和转录组数据中筛选并提取所有注释为ILP基因的序列。所获得的序列作为query,在NCBI Blast网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上进行比对,筛选出与其他物种ILP基因相似度较高的序列。将这些序列提交至ExPASy translatetool网站(http://web.expasy.org/translate/),得到翻译后的氨基酸序列。所有的氨基酸序列提交至SMART网站(http://smart.embl-heidelberg.de/),预测其是否具有典型的功能结构域。最后,对这些序列的结构域进行筛选,最终鉴定出一条ILP基因序列,并命名为LvILP1。
将LvILP1基因的cDNA序列在对虾基因组网站(http://www.shrimpbase.net/lva.download.html)进行BLASTN比对,获得该基因在基因组上的位置信息。根据比对结果,当某段序列和基因组的比对率在97%以上时被认定为精确匹配,从而得到基因的结构信息。
1.3.2 总RNA的提取及cDNA第一链的合成将收集的样品进行预处理,体积较大的组织(如肌肉、肝胰腺),采用液氮研磨法处理,其他体积较小的组织低温匀浆处理。将处理好的对虾组织样品使用RNAiso Plus试剂(TaKaRa, 日本)提取总RNA,通过Nanodrop 2000分光光度计(Thermo Fisher Scientific, 美国)和1.5% (w/v)琼脂糖凝胶电泳分别检测RNA的浓度和质量,最后使用反转录试剂盒PrimeScriptTM RT reagent kit (TaKaRa, 日本)将RNA反转录为cDNA。
1.3.3 LvILP1基因克隆将LvILP1基因序列提交至Primer 3 Plux网站(https://www.primer3plus.com/)并设计扩增全长的引物(表 1)。以脑组织的cDNA作为模板,使用PCR仪进行扩增。PCR程序:95 ℃预变性2 min;95 ℃变性20 s,60 ℃退火40 s,72 ℃延伸20 s,40个循环;72 ℃延长10 min。获得的PCR产物经1.5% (w/v)琼脂糖凝胶电泳检测,验证条带大小一致后,使用MiniBEST DNA fragment purification试剂盒(TaKaRa, 日本)进行纯化。纯化后的DNA连接到pMD19-T vector (TaKaRa, 日本)中,连接体系:pMD19-T vector 0.5 μL, Solution Ⅰ 5.0 μL及DNA纯化产物4.5 μL,置于16 ℃水浴锅中连接12 h。之后转入E. coli Trans DH5α感受态细胞(TaKaRa, 日本)中过夜培养,筛选阳性单克隆并进行菌落PCR鉴定,将含有目的基因的菌液进行测序(上海生工)。
|
|
表 1 本研究所用引物 Tab.1 The primers used in this study |
通过在线网站工具推断LvILP1基因的核苷酸序列与氨基酸序列所包含的生物学信息,采用ExPASy中的ProtParam (https://web.expasy.org/protparam/)预测蛋白质的相对分子质量、等电点、不稳定系数和平均疏水率(Wilkins et al, 1999);SignalIP-5.0 (https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测信号肽;TMHMM Server 2.0 (https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测蛋白质有无跨膜结构域;PSORT Ⅱ Prediction (https://psort.hgc.jp/form2.html)预测蛋白质亚细胞定位;SMART预测蛋白质结构域;SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质二级结构;QUARK (https://zhanggroup.org/QUARK/)预测蛋白质三级结构,预测结果用SAVES v6.0 (https://saves.mbi.ucla.edu/)进行质量评估;Neuropred (http://stagbeetle.animal.uiuc.edu/cgi-bin/neuropred.py)预测形成成熟多肽的断裂位点;MethPrimer (http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)预测CpG岛;AnimalsTFDB 3.0 (http://bioinfo.life.hust.edu.cn/AnimalTFDB/#!/)和PROMO (http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promo.cgi?dirDB=TF_8.3&calledBy=alggen)预测转录因子(Messeguer et al, 2002);STRING (https://cn.string-db.org/)预测互作蛋白;Jalview软件比对LvILP1与其他物种及胰岛素超家族基因在序列上的保守性;SMART预测获得LvILP1及胰岛素超家族成员的结构域区段序列,使用MEGA-X软件中的邻接法(Neighbor-Joining)对这些序列进行系统进化分析,同时使用MEME网站(https://meme-suite.org/meme/)预测序列保守的motif。
1.3.5 LvILP1基因在发育时期的表达特征凡纳滨对虾早期发育过程大体可分为胚胎期、无节幼体期、溞状幼体期、糠虾幼体期和仔虾期5个阶段。本实验室前期收集了凡纳滨对虾早期发育各阶段多个时期的混合样品作为检测样品,完成了早期发育5个阶段的转录组测序(Wei et al, 2014),并获得每个转录本的相对表达量FPKM (Fragments Per Kilobase of exon model per Million mapped fragments)值。本研究从中提取LvILP1基因在每个发育时期的FPKM值,并导入GraphPad Prism 7.0软件绘图。
1.3.6 LvILP1基因组织表达的实时定量分析在Primer 3 Plux网站上设计荧光定量的引物(表 1),设置检测片段长度为200 bp左右。将组织样品的cDNA稀释至适当浓度,使用Eppendorf Mastercycler ep realplex(Eppendorf, 德国)仪器进行RT-qPCR检测LvILP1在各组织中的相对表达量,同时18S rRNA的表达量作为参照。RT-qPCR程序:95 ℃预变性2 min;95 ℃变性20 s,56 ℃退火20 s,72 ℃延伸20 s,40个循环;72 ℃延长10 min。每个样品有4个技术重复,引物的熔融曲线被作为PCR产物特异性的依据。最后,使用2−ΔΔCt法计算基因的相对表达量。
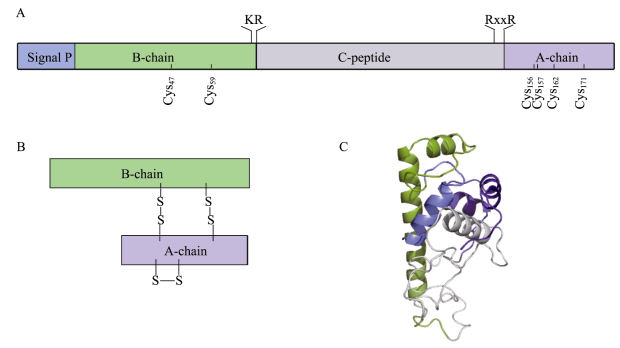
2 结果与分析 2.1 LvILP1基因序列分析从凡纳滨对虾转录组数据中筛选得到一条与斑节对虾(Penaeus monodon) ILP有87.93%相似性的序列,SMART预测显示,其具有完整的IlGF结构域,该结构域是胰岛素超家族的特征结构域,由此我们确认该基因为凡纳滨对虾ILP基因,将其命名为LvILP1 (GenBank登录号:ON973859)。在凡纳滨对虾基因组网站上进行BLASTN比对,发现LvILP1基因位于基因组的LVANscaffold_2976上,由6个外显子组成。序列分析显示,LvILP1基因mRNA全长为812 bp,开放阅读框为543 bp,编码180个氨基酸。ProtParam预测其编码的蛋白分子量为20.81 kDa,理论等电点为9.45,不稳定系数为96.20,平均疏水率为–0.795,由此推测,LvILP1为碱性不稳定的亲水蛋白。TMHMM Server 2.0、SignalIP-5.0和PSORT Ⅱ Prediction预测显示,LvILP1没有跨膜结构,有一个N端信号肽,且定位在细胞膜外,属于分泌型蛋白。Neuropred预测显示,LvILP1存在KR和RRRR两个可能的断裂位点,蛋白水解酶通过断裂位点将其中间的序列(C肽)切割以形成成熟的多肽;信号肽之后与KR断裂位点前的序列为B链,RRRR断裂位点之后的序列为A链,A链、B链上分别存在4个和2个保守的半胱氨酸,其中,Cys156-Cys162由A链内的二硫键相连,Cys47-Cys157和Cys59-Cys171由链间二硫键相连,共形成3个二硫键(图 1和图 2A、B)。SOPMA和QUARK预测显示,LvILP1的A、B链均主要由2个α-螺旋结构组成,A链的α-螺旋由1个Loop连接,B链内的2个α-螺旋由β-转角连接(图 2C)。

|
图 1 LvILP1基因序列 Fig.1 LvILP1 gene sequence 蓝色字体代表信号肽序列;红色加粗字体代表保守的氨基酸位点;黑色加粗字体代表断裂位点;绿色方框内的序列代表A、B链,B链在信号肽序列后;斜体代表C肽。 A signal peptide sequence is highlighted in blue font; the conserved amino acid sites are indicated in red bold; the cleavage sites are bolded with black font; the sequences in green box represent A-chain and B-chain, and B-chain is following signal peptide; C-peptide is marked in italics. |
|
图 2 LvILP1的结构模型 Fig.2 Structure model of LvILP1 A:LvILP1线性结构模型;B:LvILP1加工为激素的线性结构模型;C:预测的LvILP1蛋白三级结构。蓝色代表信号肽,绿色代表B链,灰色代表C肽,紫色代表A链。 A: Linear structure model of LvILP1; B: Linear structure model of LvILP1 processing as hormone; C: Predicted 3-D structure of LvILP1 protein. The color blue represents signal peptide, the green represents B-chain, the gray represents C-peptide, and the purple represents A-chain. |
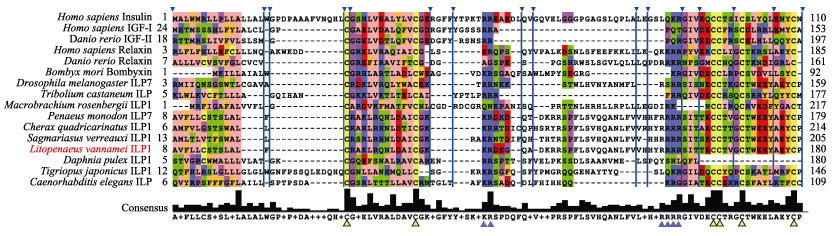
通过Jalview软件将推导的LvILP1氨基酸序列与其他物种ILP及胰岛素超家族基因编码的氨基酸序列进行比对,结果显示,该序列与斑节对虾ILP7相似性最高(87.78%),其次是东澳岩龙虾ILP1 (53.20%)、红螯螯虾(Cherax quadricarinatus) ILP1 (52.80%)、蚤状溞(Daphnia pulex) ILP1 (40.74%),与黑腹果蝇ILP7、人类(Homo sapiens) relaxin、人类insulin相似性较低(33%以下),表明ILP氨基酸序列在不同物种中及与胰岛素超家族成员之间保守性不高,但它们都具有保守的6个半胱氨酸与2个断裂位点(图 3)。
|
图 3 LvILP1多序列比对 Fig.3 Multiple sequence alignment of LvILP1 黄色三角形表示保守的半胱氨酸位点,蓝色三角形表示保守的断裂位点。GenBank accession number: 人类Homo sapiens insulin (AAA59172.1), 人类H. sapiens IGF-Ⅰ(CAA40342.1), 斑马鱼Danio rerio IGF-Ⅱ(AAH85623.1), 人类H. sapiens relaxin (CAA00599.1), 斑马鱼D. rerio relaxin (AEL22115.1), 家蚕Bombyx mori bombyxin (BAA00246.1), 黑腹果蝇Drosophila melanogaster ILP7 (NP_570070.1), 赤拟谷盗Tribolium castaneum ILP (EEZ99258.2), 罗氏沼虾Macrobrachium rosenbergii ILP1 (QIW91885.1), 斑节对虾Penaeus monodon ILP7 (XP_037788563.1), 红螯螯虾Cherax quadricarinatus ILP1 (AIU40992.1), 东澳岩龙虾Sagmariasus verreauxi ILP1 (AIU40991.1), 凡纳滨对虾Litopenaeus vannamei ILP1 (ON973859), 蚤状溞Daphnia pulex ILP1 (EFX76240.1), 日本虎斑猛水溞Tigriopus japonicus ILP1 (AIW65597.1), 秀丽隐杆线虫Caenorhabditis elegans ILP (AAC33275.1). Yellow triangles indicate the conserved cysteine sites and blue triangles represent the conserved cleavage sites. |
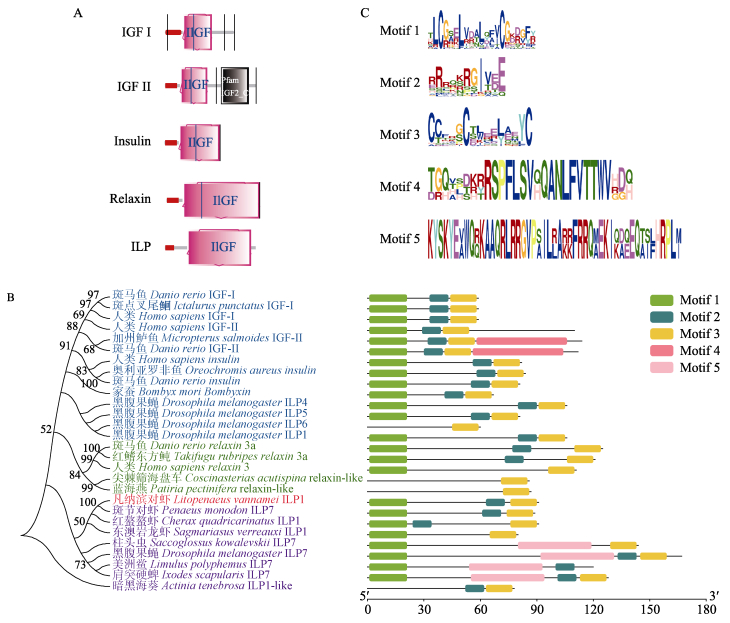
将多个物种的胰岛素超家族成员insulin、IGF-Ⅰ、IGF-Ⅱ、relaxin和ILP的氨基酸序列通过SMART网站预测结构域,显示它们均具有IlGF结构域;不同的是,IGF-Ⅱ比其他成员多了一个Pfam IGF2结构域(图 4A)。选取结构域区段序列采用邻接法构建系统进化树(图 4B),结果显示,以海葵ILP作为外群,该进化树可以分为3个大支:一是凡纳滨对虾ILP与斑节对虾ILP7、红螯螯虾ILP1、东澳岩龙虾ILP1、美洲鲎ILP7、果蝇ILP7、肩突硬蜱ILP7以及柱头虫ILP7亲缘关系最近,聚为一支;二是脊椎动物与棘皮动物Relaxin聚为一支;三是脊椎动物IGF-Ⅰ、IGF-Ⅱ及Insulin聚为一支,然后依次与家蚕bombyxin、果蝇ILP7之外的ILPs聚为一大支。对这些序列进行motif预测,发现所有胰岛素超家族成员都具有motif1、motif2和motif3,而motif4仅存在于IGF-Ⅱ,motif5仅存在于甲壳动物中。对motif序列进行分析发现,motif1具有2个高度保守的半胱氨酸位点,存在于B链;motif2存在多个保守的精氨酸位点,为A链前端的RxxR断裂位点;motif3具有4个高度保守的半胱氨酸位点,存在于A链(图 4C)。
|
图 4 LvILP1的系统进化树及motif预测 Fig.4 Evolutionary tree and predicted motif of LvILP1 A:胰岛素超家族成员的IlGF结构域;B:LvILP1的系统进化树;C:胰岛素超家族成员预测的motif。GenBank accession No.: Danio rerio IGF-Ⅰ(NP_571900.1), Ictalurus punctatus IGF-Ⅰ(AAZ28918.1), Homo sapiens IGF-Ⅰ(CAA40342.1), H. sapiens IGF-Ⅱ(NP_001278791.1), Micropterus salmoides IGF-Ⅱ(ACS92730.1), D. rerio IGF-Ⅱ (AAH85623.1), H. sapiens insulin (AAA59172.1), Oreochromis aureus insulin (XP_031615350.1), D. rerio insulin (CAC20109.1), Bombyx mori bombyxin (BAA00246.1), Drosophila melanogaster ILP4 (NP_648361.1), D. melanogaster ILP5 (NP_996037.2), D. melanogaster ILP6 (NP_570000.1), D. melanogaster ILP1 (NP_648359.1), D. rerio relaxin 3a (NP_001032892.1), Takifugu rubripes relaxin 3a (NP_001092112.1), H. sapiens relaxin 3 (AAL40345.1), Coscinasterias acutispina relaxin-like (BAU68093.1), Atiria pectinifera relaxin-like (BAQ35470.1), Ixodes scapularis ILP7 (XP_029841940.1), Limulus polyphemus ILP7 (XP_022245174.1), D. melanogaster ILP7 (NP_570070.1), Saccoglossus kowalevskii ILP7 (XP_006815151.1), Sagmariasus verreauxi ILP1 (AIU40991.1), Cherax quadricarinatus ILP1 (AIU40992.1), Penaeus monodon ILP7 (XP_037788563.1), Litopenaeus vannamei ILP1 (ON973859), Actinia tenebrosa ILP1-like (XP_031575451.1). A: The IlGF domain of insulin superfamily members; B: Evolutionary tree of LvILP1; C: Motif predicted with insulin superfamily members. |
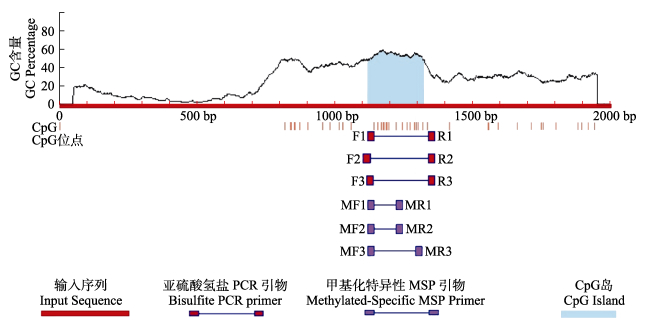
通过MethPrimer程序预测,在LvILP1基因的转录起始位点上游NW_020870482.1 c38863-36863区域(启动子区域)内存在一个CpG岛,大小为203 bp,GC含量大于50%,包含16个CpG位点(图 5)。
|
图 5 LvILP1启动子区域内的CpG岛 Fig.5 CpG island in the promoter region of LvILP1 |
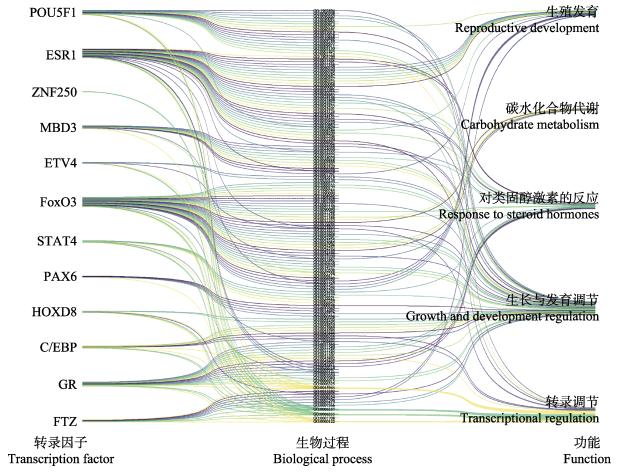
从AnimalTFDB 3.0和PROMO网站上同时预测LvILP1基因5´侧翼区2 Kb序列上的转录因子结合位点,AnimalTFDB 3.0预测的转录因子设定P < 10–13,PROMO预测的转录因子设置最大矩阵相异率(容错率)为0。选取最优预测的前12个转录因子,统计其参与的生物过程,并进行功能归类。结果显示,LvILP1基因的转录因子主要具有5类功能,分别是转录调节、生长与发育调节、对类固醇激素的反应、碳水化合物代谢、生殖发育。此外,预测的转录因子叉头框蛋白O3 (forkhead box O3, FoxO3)是胰岛素通路的下游基因,糖皮质激素受体(glucocorticoid receptor, GR)是胰岛素的转录因子,CAAT区/增强子结合蛋白(CCAAT/enhancer-binding protein, C/EBP)、信号传导及转录激活蛋白(signal transducer and activator of transcription, STAT)是IGF-Ⅰ的转录因子(图 6)。
|
图 6 LvILP1的转录因子及功能预测 Fig.6 Transcription factor and functional prediction of LvILP1 |
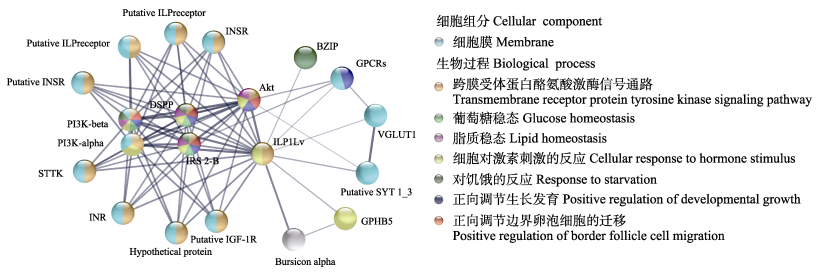
通过STRING在线数据库检索与LvILP1相互作用的蛋白,要求最低的交互分数为0.4。如图 7所示,LvILP1与多个胰岛素超家族的受体INSR (insulin receptor)、InR (insulin-like receptor)、Putative ILP receptor、IGF-1R (insulin like growth factor 1 receptor),胰岛素受体底物(insulin receptor substrate 2-B, IRS-2B)以及G蛋白偶联受体(G protein-coupled receptors, GPCRs)等相互作用,同时也与含特定结构域(STTK、BZIP)的蛋白质,神经相关的蛋白VGLUT1 (vesicular glutamate transporters 1)、putative SYT 1_3 (synaptotagmin),表皮与骨架相关的蛋白Bursicon alpha、DSPP (dentin sialophosphoprotein),糖蛋白激素(glycoprotein hormone beta 5, GPHB5),胰岛素通路下游蛋白PI3K、Akt (threonine/serine protein kinase)相互作用。对这些互作蛋白参与的生物过程进行分析,从而推测LvILP1参与了跨膜受体蛋白酪氨酸激酶信号通路、细胞对激素刺激的反应、葡萄糖稳态、脂质稳态、对饥饿的反应、正向调节生长发育以及正向调节边界卵泡细胞的迁移等生物过程。
|
图 7 LvILP1互作蛋白及其参与的生物过程 Fig.7 Interacting proteins of LvILP1 and the biological processes involved |
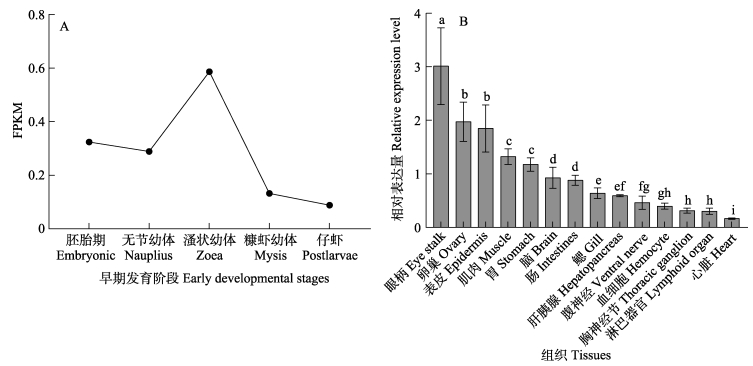
凡纳滨对虾早期发育阶段的转录组数据显示,LvILP1在早期不同的发育阶段均有表达,在溞状幼体时期表达量最高,之后表达量逐渐下降(图 8A)。RT-qPCR分析凡纳滨对虾成体不同组织中LvILP1的表达特征,结果显示,LvILP1在凡纳滨对虾各组织中均有表达,但表达量有差异,在眼柄中表达量最高,其次是卵巢、表皮、肌肉、胃、脑、肠等组织(图 8B),这表明LvILP1基因表达广泛,在多种组织中具有重要的生物学作用。
|
图 8 LvILP1基因的表达特征 Fig.8 The expression profiles of LvILP1 gene A:LvILP1在早期发育阶段中的表达;B:LvILP1在对虾各组织中的表达。柱上不同字母代表差异显著(P < 0.05)。 A: Expression of LvILP1 in early development stages; B: Expression of LvILP1 in adult tissues. Different letters represent significant differences (P < 0.05). |
本研究鉴定了一种凡纳滨对虾ILP基因,蛋白理化性质分析结果显示LvILP1属于碱性不稳定的亲水性蛋白。在脊椎动物中,胰岛素是通过与细胞表面的糖蛋白受体结合从而发挥作用(Kahn, 1985),与之一致的是,LvILP1定位在细胞膜外,可能与胰岛素一样通过与细胞膜上的受体结合从而发挥生物学功能。结构分析显示,LvILP1具有胰岛素超家族典型的IlGF结构域,由N端信号肽、B链、C肽、A链组成,说明LvILP1属于胰岛素超家族成员。Pierce等(2001)将秀丽隐杆线虫中的40种ins基因根据其二硫键的排列顺序分为α、β和γ三种类型;LvILP1在A链上有4个保守的半胱氨酸,其中第1个保守的半胱氨酸通过二硫键连接到第3个,而第2个和第4个通过链间二硫键分别与B链中的2个保守半胱氨酸相连,共形成3个二硫键,属于γ型蛋白。胰岛素的A链是由Loop连接的2个α-螺旋组成,B链由延伸的N-末端、α-螺旋、β-转角和延伸的C-末端组成(Murray-Rust et al, 1992),不同的是,凡纳滨对虾LvILP1具有无规卷曲结构,且A、B链均主要由2个α-螺旋结构组成,由此推测α-螺旋结构中存在LvILP1发挥功能的位点,但其具体的功能位点及机制有待进一步研究。
多序列比对显示,无脊椎动物中ILP基因的序列并不保守,但都具有IlGF结构域,这可能与A、B链上存在保守的半胱氨酸以及保守的断裂位点有关,这些保守位点对ILP基因的功能结构域十分重要,所以在长期进化过程中被保留,而基因序列的变化可能是为了适应生存环境变化而不断发生的突变。此外,我们发现,无脊椎动物中软甲纲十足目的ILP结构域区段序列最长,且在C肽内存在特别的motif5,说明十足目ILP在进化过程中发生了序列扩张。系统进化分析显示,海葵ILP作为外群,胰岛素超家族基因初步分为3个大支,无脊椎动物ILP7类与甲壳动物ILP聚为一个大支,脊椎动物与棘皮动物Relaxin聚为一支,脊椎动物IGF-Ⅰ、IGF-Ⅱ、Insulin与ILP7之外的昆虫其他ILPs聚为一个大支。其中,无脊椎动物ILP7类在进化距离上与海葵ILP最近,暗示ILP7类可能更接近于胰岛素超家族的祖先基因;果蝇ILP7与甲壳动物ILP聚在一起,说明果蝇中ILP7与甲壳动物ILP的亲缘关系较近,其可能与昆虫ILP的起源有关;脊椎动物Relaxin 3与棘皮动物Relaxin-like聚为一支,说明Relaxin在进化中比较保守,它们的进化关系介于无脊椎动物ILP7类、甲壳动物ILP与脊椎动物IGF、Insulin及昆虫ILPs之间;ILP7之外的昆虫其他ILPs与脊椎动物Insulin聚在一起,表明昆虫一部分ILPs与脊椎动物Insulin的亲缘关系较近。在基因进化研究中,Cui等(2021)发现,昆虫ILP7类比胰岛素超家族其比成员更古老;此外,人类中的研究显示Relaxin 3是Relaxin家族的祖先基因(Chan et al, 2011),同时,鱼类中发现Relaxin与Insulin、IGF的祖先同源性较高(Caruso et al, 2011),而哺乳动物Relaxin和Insulin-like基因的单拷贝祖先在产生功能分化之前经历了2轮全基因组复制(Hoffmann et al, 2011)。这与本研究的结果基本一致,由此说明无脊椎动物ILP7类可能是更为古老的基因,胰岛素超家族成员的进化顺序可能为ILP、Relaxin、Insulin、IGF-Ⅱ、IGF-Ⅰ。它们的结构特点也提供一些线索,ILP、Relaxin、Insulin形成成熟的蛋白需要切割C肽,而IGF-Ⅰ与IGF-Ⅱ则是需要切割在羧基末端存在的E肽(为预测的motif4) (Pierce et al, 2001)。
早期发育阶段的转录组数据显示,LvILP1在早期发育阶段均有表达,这与IGF促进生长发育的功能相似(Alekseenkova et al, 2022),说明LvILP1对对虾的生长发育有重要作用。荧光定量分析显示,LvILP1在成体对虾各组织中均有表达,这与果蝇ILP7只在少数神经细胞表达不同;LvILP1在眼柄中相对表达量最高,这与罗氏沼虾中的结果一致(Jiang et al, 2020),甲壳类动物眼柄中的X–器官–窦腺复合体(X-organ-sinus gland complex, XO-SG)是重要的神经内分泌器官,也是神经肽激素的表达位置(Grunewald et al, 1995; Amo et al, 2011),这与昆虫中多种ILP主要在大脑神经分泌细胞中表达相似;此外,LvILP1在卵巢、表皮、肌肉、胃等组织中表达量较高,推测LvILP1对这些组织中的特异性生理活动具有调节作用。
LvILP1基因转录因子预测显示,关键转录因子FoxO3是胰岛素信号通路的下游基因,GR是胰岛素的转录因子,C/EBP和STAT是IGF-Ⅰ的转录因子,它们在控制细胞周期、细胞凋亡与自噬、细胞分化与增殖、生长发育、新陈代谢等一系列基本生物过程中具有重要作用(Lu et al, 2005; Xin et al, 2020; Yin et al, 2020; Calissi et al, 2021),因此,我们推测FoxO3、GR、C/EBP和STAT参与调控LvILP1基因的转录。另一方面,基因转录与启动子区中CpG岛的甲基化状态有关,若CpG序列中的C未被甲基化,基因可以正常转录,反之基因转录被抑制(Jones et al, 2022);本研究在LvILP1启动子区域内发现一个203 bp的CpG岛,其中包含16个CpG位点,这可能对LvILP1基因的转录具有重要的调节作用。
互作蛋白预测显示,LvILP1能够与胰岛素超家族基因的受体相结合,同时与VGLUT1、Putative SYT 1_3、GPHB5、Bursicon alpha等分子相互作用;VGLUT1是囊泡型谷氨酸转运蛋白1,其功能是将中枢神经系统(Central Nervous System, CNS)中的主要兴奋性神经递质谷氨酸输送到突触囊泡中(Du et al, 2020);Putative SYT 1_3是突触结合蛋白,介导神经元和神经内分泌细胞中的超快胞吐作用,从而促进神经递质和神经肽激素的分泌(Park et al, 2018);GPHB5是糖蛋白激素,可激活促甲状腺激素释放激素受体结合活性,作用于甲状腺激素介导的信号通路参与生长发育的调节(Querat, 2021);Bursicon称为鞣化激素,是昆虫蜕皮后过程中的主要调节激素,在旧表皮层脱落后,鞣化激素被合成并释放到血淋巴中,促进新表皮层硬化(Dong et al, 2015; Scopelliti et al, 2016)。
进化树分析显示LvILP1与果蝇ILP7聚在一支,说明它们很可能具有相似的功能。在果蝇中表达ILP7的神经元参与Bursicon引起的外骨骼硬化(Flaven-Pouchon et al, 2020),说明ILP7可能与Bursicon有互作以调节表皮组织的形成;雌性果蝇需要特异性ILP7表达来促进产卵中输卵管的功能(Garner et al, 2018);埃及伊蚊中ILP7参与调节脂质代谢,从而控制卵巢发育所需的能量(Ling et al, 2017)。
以上结合LvILP1基因的表达特征、转录因子预测、互作蛋白分析及果蝇ILP7的研究,我们推测LvILP1在调控对虾生长发育、对激素刺激的反应、神经系统稳态、碳水化合物稳态、蜕皮后组织重建以及生殖发育中发挥作用。本研究为进一步探索凡纳滨对虾ILP基因的结构与功能打下基础,同时也为凡纳滨对虾的分子遗传育种提供候选基因。
ALEKSEENKOVA E N, SELKOV S A, KAPUSTIN R V. Fetal growth regulation via insulin-like growth factor axis in normal and diabetic pregnancy. Journal of Perinatal Medicine, 2022, 50(7): 947-960 DOI:10.1515/jpm-2021-0510 |
AMO K, ARAI H, UEBANSO T, et al. Effects of xylitol on metabolic parameters and visceral fat accumulation. Journal of Clinical Biochemistry and Nutrition, 2011, 49(1): 1-7 DOI:10.3164/jcbn.10-111 |
CALISSI G, LAM E W, LINK W. Therapeutic strategies targeting FOXO transcription factors. Nature Reviews Drug Discovery, 2021, 20(1): 21-38 DOI:10.1038/s41573-020-0088-2 |
CARUSO M A, SHERIDAN M A. New insights into the signaling system and function of insulin in fish. General and Comparative Endocrinology, 2011, 173(2): 227-247 DOI:10.1016/j.ygcen.2011.06.014 |
CHAN L J, HOSSAIN M A, SAMUEL C S, et al. The relaxin peptide family―structure, function and clinical applications. Protein and Peptide Letters, 2011, 18(3): 220-229 DOI:10.2174/092986611794578396 |
CHANDLER J C, GANDHI N S, MANCERA R L, et al. Understanding insulin endocrinology in decapod crustacea: Molecular modelling characterization of an insulin-binding protein and insulin-like peptides in the Eastern spiny lobster, Sagmariasus verreauxi. International Journal of Molecular Sciences, 2017, 18(9): 1832 DOI:10.3390/ijms18091832 |
CHRISTIE A E, RONCALLI V, LENZ P H. Diversity of insulin-like peptide signaling system proteins in Calanus finmarchicus (Crustacea; Copepoda) - Possible contributors to seasonal pre-adult diapause. General and Comparative Endocrinology, 2016, 236: 157-173 DOI:10.1016/j.ygcen.2016.07.016 |
CUI Z X, LIU Y, YUAN J B, et al. The Chinese mitten crab genome provides insights into adaptive plasticity and developmental regulation. Nature Communications, 2021, 12(1): 2395 DOI:10.1038/s41467-021-22604-3 |
DONG S, ZHANG H, CHEN X, et al. The neuropeptide bursicon acts in cuticle metabolism. Archives of Insect Biochemistry and Physiology, 2015, 89(2): 87-97 DOI:10.1002/arch.21227 |
DU X, LI J, LI M, et al. Research progress on the role of type I vesicular glutamate transporter (VGLUT1) in nervous system diseases. Cell Bioscience, 2020, 10: 26 DOI:10.1186/s13578-020-00393-4 |
FANG Z P, MENG X H, LI X P, et al. Genetic diversity analysis of domestic commercial brands seedlings of Litopenaeus vannamei based on microsatellite molecular markers. Progress in Fishery Sciences, 2020, 41(5): 101-109 [方振朋, 孟宪红, 李旭鹏, 等. 基于微卫星分子标记的凡纳滨对虾商业苗种遗传多样性分析. 渔业科学进展, 2020, 41(5): 101-109] |
FLAVEN-POUCHON J, ALVAREZ J V, ROJAS C, et al. The tanning hormone, bursicon, does not act directly on the epidermis to tan the Drosophila exoskeleton. BMC Biology, 2020, 18(1): 17 DOI:10.1186/s12915-020-0742-5 |
FU K Y, ZHU T T, GUO W C, et al. Knockdown of a putative insulin-like peptide gene LdILP2 in Leptinotarsa decemlineata by RNA interference impairs pupation and adult emergence. Gene, 2016, 581(2): 170-177 DOI:10.1016/j.gene.2016.01.037 |
GARNER S R C, CASTELLANOS M C, BAILLIE K E, et al. Drosophila female-specific Ilp7 motoneurons are generated by Fruitless-dependent cell death in males and by a double-assurance survival role for Transformer in females. Development, 2018, 145(1): dev150821 |
GRUNEWALD R W, WEBER I I, KINNE R K. Renal inner medullary sorbitol metabolism. American Journal of Physiology, 1995, 269(5 Pt 2): F696-701 |
HADDAD A N, LEYRIA J, LANGE A B. Identification of a tachykinin receptor and its implication in carbohydrate and lipid homeostasis in Rhodnius prolixus, a chagas disease vector. General and Comparative Endocrinology, 2022, 320: 114010 DOI:10.1016/j.ygcen.2022.114010 |
HOFFMANN F G, OPAZO J C. Evolution of the relaxin/insulin-like gene family in placental mammals: Implications for its early evolution. Journal of Molecular Evolution, 2011, 72(1): 72-79 DOI:10.1007/s00239-010-9403-6 |
JIANG Q, JIANG Z, GU S, et al. Insights into carbohydrate metabolism from an insulin-like peptide in Macrobrachium rosenbergii. General and Comparative Endocrinology, 2020, 293: 113478 DOI:10.1016/j.ygcen.2020.113478 |
JONES E R, GRIFFITT R J. Oil and hypoxia alter DNA methylation and transcription of genes related to neurological function in larval Cyprinodon variegatus. Aquatic Toxicology, 2022, 251: 106267 DOI:10.1016/j.aquatox.2022.106267 |
KAHN C R. The molecular mechanism of insulin action. Annual Review of Medicine, 1985, 36: 429-451 DOI:10.1146/annurev.me.36.020185.002241 |
LI F, ZHANG S, FU C, et al. Molecular and functional analysis of the insulin-like peptides gene in the oriental river prawn Macrobrachium nipponense. General and Comparative Endocrinology, 2019, 280: 209-214 DOI:10.1016/j.ygcen.2019.05.006 |
LI Y N, REN X B, LIU Z C, et al. Insulin-like peptide and FoxO mediate the trehalose catabolism enhancement during the diapause termination period in the Chinese oak silkworm (Antheraea pernyi). Insects, 2021, 12(9): 784 DOI:10.3390/insects12090784 |
LIAO S, POST S, LEHMANN P, et al. Regulatory roles of Drosophila insulin-like peptide 1 (DILP1) in metabolism differ in pupal and adult stages. Frontiers in Endocrinology, 2020, 11: 180 DOI:10.3389/fendo.2020.00180 |
LING L, KOKOZA V A, ZHANG C, et al. MicroRNA-277 targets insulin-like peptides 7 and 8 to control lipid metabolism and reproduction in Aedes aegypti mosquitoes. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(38): e8017-e8024 |
LIU J Y, LIU J H, KONG J, et al. Development of SNP markers and verification analysis of relationship on family in Litopenaeus vannamei. Progress in Fishery Sciences, 2021, 42(1): 108-116 [刘峻宇, 刘均辉, 孔杰, 等. 凡纳滨对虾SNP标记开发与家系亲缘关系验证分析. 渔业科学进展, 2021, 42(1): 108-116] |
LIU Y, LIAO S, VEENSTRA J A, et al. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Scientific Reports, 2016, 6: 26620 DOI:10.1038/srep26620 |
LU N Z, CIDLOWSKI J A. Translational regulatory mechanisms generate N-terminal glucocorticoid receptor isoforms with unique transcriptional target genes. Molecular Cell, 2005, 18(3): 331-342 DOI:10.1016/j.molcel.2005.03.025 |
MESSEGUER X, ESCUDERO R, FARRé D, et al. PROMO: Detection of known transcription regulatory elements using species-tailored searches. Bioinformatics, 2002, 18(2): 333-334 DOI:10.1093/bioinformatics/18.2.333 |
MITCHELL M L, HOSSAIN M A, LIN F, et al. Identification, synthesis, conformation and activity of an insulin-like peptide from a Sea Anemone. Biomolecules, 2021, 11(12): 1785 DOI:10.3390/biom11121785 |
MURRAY-RUST J, MCLEOD A N, BLUNDELL T L, et al. Structure and evolution of insulins: Implications for receptor binding. Bioessays, 1992, 14(5): 325-331 DOI:10.1002/bies.950140507 |
NAGATA K, MARUYAMA K, KOJIMA K, et al. Prothoracicotropic activity of SBRPs, the insulin-like peptides of the saturniid silkworm Samia cynthia ricini. Biochemical and Biophysical Research Communications, 1999, 266(2): 575-578 DOI:10.1006/bbrc.1999.1865 |
PANG Y, ZHANG X, YUAN J, et al. Characterization and expression analysis of insulin growth factor binding proteins (IGFBPs) in Pacific White Shrimp Litopenaeus vannamei. International Journal of Molecular Sciences, 2021a, 22(3): 1056 DOI:10.3390/ijms22031056 |
PANG Y, ZHANG X, YUAN J, et al. Glycogen synthase kinase 3 gene is important in growth and molting of the Pacific white shrimp Litopenaeus vannamei. Frontiers in Marine Science, 2021b, 8: 681966 DOI:10.3389/fmars.2021.681966 |
PARK Y, RYU J K. Models of synaptotagmin-1 to trigger Ca(2+) -dependent vesicle fusion. FEBS Letters, 2018, 592(21): 3480-3492 DOI:10.1002/1873-3468.13193 |
PERILLO M, ARNONE M I. Characterization of insulin-like peptides (ILPs) in the sea urchin Strongylocentrotus purpuratus: Insights on the evolution of the insulin family. General and Comparative Endocrinology, 2014, 205: 68-79 DOI:10.1016/j.ygcen.2014.06.014 |
PIERCE S B, COSTA M, WISOTZKEY R, et al. Regulation of DAF-2 receptor signaling by human insulin and ins-1, a member of the unusually large and diverse C. elegans insulin gene family. Genes and Development, 2001, 15(6): 672-686 DOI:10.1101/gad.867301 |
QUERAT B. Unconventional actions of glycoprotein hormone subunits: A comprehensive review. Frontiers in Endocrinology, 2021, 12: 731966 DOI:10.3389/fendo.2021.731966 |
RIEHLE M A, FAN Y, CAO C, et al. Molecular characterization of insulin-like peptides in the yellow fever mosquito, Aedes aegypti: Expression, cellular localization, and phylogeny. Peptides, 2006, 27(11): 2547-2560 DOI:10.1016/j.peptides.2006.07.016 |
SCOPELLITI A, BAUER C, CORDERO J B, et al. Bursicon-α subunit modulates dLGR2 activity in the adult Drosophila melanogaster midgut independently to Bursicon-β. Cell Cycle, 2016, 15(12): 1538-1544 DOI:10.1080/15384101.2015.1121334 |
SU M, ZHANG X, YUAN J, et al. The role of insulin-like peptide in maintaining hemolymph glucose homeostasis in the Pacific white shrimp Litopenaeus vannamei. International Journal of Molecular Sciences, 2022, 23(6): 3268 DOI:10.3390/ijms23063268 |
WANG L, CHEN H, WANG L, et al. An insulin-like peptide serves as a regulator of glucose metabolism in the immune response of Chinese mitten crab Eriocheir sinensis. Developmental and Comparative Immunology, 2020, 108: 103686 DOI:10.1016/j.dci.2020.103686 |
WANG Z, TAN D, WANG F, et al. Insulin peptides and their receptors regulate ovarian development and oviposition behavior in Diaphorina citri. Insect Science, 2022, 30(1): 95-108 |
WEI J, ZHANG X, YU Y, et al. Comparative transcriptomic characterization of the early development in Pacific white shrimp Litopenaeus vannamei. PLoS One, 2014, 9(9): e106201 DOI:10.1371/journal.pone.0106201 |
WILKINS M R, GASTEIGER E, BAIROCH A, et al. Protein identification and analysis tools in the ExPASy server. Methods in Molecular Biology, 1999, 112: 531-552 |
WU Q, BROWN M R. Signaling and function of insulin-like peptides in insects. Annual Review of Entomology, 2006, 51: 1-24 DOI:10.1146/annurev.ento.51.110104.151011 |
XIN P, XU X, DENG C, et al. The role of JAK/STAT signaling pathway and its inhibitors in diseases. International Immunopharmacology, 2020, 80: 106210 DOI:10.1016/j.intimp.2020.106210 |
YAMAGUCHI S T, KOBAYASHI R, TOMITA J, et al. The regulation of circadian rhythm by insulin signaling in Drosophila. Neuroscience Research, 2022, 183: 76-83 DOI:10.1016/j.neures.2022.07.005 |
YIN H M, YAN L F, LIU Q, et al. Activating transcription factor 3 coordinates differentiation of cardiac and hematopoietic progenitors by regulating glucose metabolism. Science Advances, 2020, 6(19): 9466 DOI:10.1126/sciadv.aay9466 |
ZHENG S, CHIU H, BOUDREAU J, et al. A functional study of all 40 Caenorhabditis elegans insulin-like peptides. Journal of Biological Chemistry, 2018, 293(43): 16912-16922 DOI:10.1074/jbc.RA118.004542 |



