2. 海水养殖生物育种与可持续产出全国重点实验室 中国水产科学研究院黄海水产研究所 山东 青岛 266071
2. State Key Laboratory of Mariculture Biobreeding and Sustainable Goods, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
贝藻养殖是我国水产养殖业的重要支柱,2021年总产量约为1 879.75万t,占全国总养殖产量的33.71%,全国海水养殖总产量的81.29%,贝藻养殖总面积约为1.364 09×106 hm2,占全国海水养殖总面积的67.34% (农业农村部渔业渔政管理局等, 2022)。养殖过程带来的环境问题也引起了学者们的广泛关注。目前,针对养殖活动对环境影响的研究大多集中在水环境方面(柴正晴等, 2022),其中,贝藻多营养层次综合养殖被公认为是可以提高水产养殖可持续性,并能实现对水环境友好的一种养殖模式(Liu et al, 2021)。同时,贝藻养殖也被认为是发展碳汇渔业,实现低碳发展的重要方式(孙威等, 2022)。然而,即使贝藻养殖能够起到净化水质的作用,在其长期养殖过程中,仍然在底栖环境中产生了明显的有机质富集(Yang et al, 2018)。因为养殖区内的水动力条件经常被养殖设施筏架和养殖生物等因素大幅削弱,水动力条件的减弱促进了有机物沉积在海底,从而改变海底沉积物原有的生物地球化学过程。海底微生物分解有机物所需的O2通常超过表层海水的供应,特别是在夏季,当温度升高,水体出现热分层或盐度温跃层时,这些情况往往会导致底层水体和沉积物缺氧(Kodama et al, 2018)。因此,在全球富营养化地区和沿海水产养殖区,夏季通常更容易出现缺氧情况(Breitburg et al, 2018)。而沉积环境中低溶解氧(DO)浓度会促进沉积物中厌氧代谢和硫酸盐还原,增加沉积物间隙水中溶解的硫化物浓度(Jørgensen et al, 2019),硫化物在还原条件下极易生成H2S,其毒性会对海洋生物带来致命威胁。目前,关于养殖活动对沉积物中微环境影响的程度和机制尚不完全清楚。
海底是有机物氧化分解的密集区,也是全球最大的厌氧生物反应器以及最大的有机碳库,在全球海洋碳循环中起到关键作用(Jørgensen et al, 2022)。沉降到海底的有机碳,一部分在微生物的作用下被矿化,剩余部分被埋藏到沉积物中。氧作为微生物活动利用效率最高的电子受体,是影响沉积物中有机碳矿化速率的决定因素之一,氧的含量以及渗透深度也影响有机碳的矿化速率(郑旻等, 2023)。海底沉积物–水界面附近的DO消耗主要包括沉积物中微生物降解有机质消耗的O2、底栖生物呼吸作用所消耗的O2以及有机质降解生成的还原性无机代谢产物被氧化所消耗的O2 (郑旻等, 2023)。自20世纪60年代起,研究中广泛采用培养箱法对沉积物总耗氧量(total oxygen uptake, TOU)进行测量,进而对沉积物的耗氧情况进行分析,该方法一直是研究海底沉积物耗氧常用的方法之一(Glud, 1994)。但该方法在测量时会对沉积物–水界面(sediment water interface, SWI)处的物质交换过程产生扰动,同时,也无法反映沉积物内的DO消耗过程(郑旻等, 2023)。研究表明,扩散边界层(diffusion boundary layer, DBL)的厚度一般在0.1 mm到几毫米之间变化,对沉积物–水界面的物质交换有重要的影响(汪嘉宁等, 2012),DO在沉积物表层几毫米到几厘米的范围内就会消耗殆尽(Jørgensen et al, 2022)。因此,为获得微观尺度内的精确变化,近年来,研究中多采用微剖面法研究沉积物中的微观化学特征变化。微剖面法能够获得观测站位海底沉积物中纵向高分辨率的微观化学特征剖面,可以较准确地反映沉积物中的DO消耗、氧渗透深度等信息(Lemburg et al, 2018)。
因此,本研究使用微剖面法,对桑沟湾不同养殖区的沉积物样品中的DO、H2S、pH的分布进行微尺度测量,精确分析沉积物–水界面和DBL的DO通量,以了解不同养殖区域沉积物内的DO消耗过程及主要影响因素,为探究养殖活动在养殖生态系统碳循环中的作用提供科技支撑。
1 材料与方法 1.1 研究区域概况以及采样站位桑沟湾位于山东半岛东部(37°01′~37°09′ N, 122°24′~122°35′ E),是一个西、北、南三面临陆地的半封闭海湾,东面通过宽11.5 km的海湾口与黄海相连,总面积约为144 km2。湾内的平均水深为7.5 m,最大水深为15 m。桑沟湾的潮流为规则半日潮,最大潮差约2 m。海带(Saccharina japonica)的规模化养殖开始于20世纪60年代,贝类的规模化筏式养殖开始于20世纪80年代。目前,桑沟湾2/3的水域都用于开展筏式贝藻的养殖。主要养殖品种包括长牡蛎(Crassostrea gigas)、栉孔扇贝(Chlamys farreri)、海带和龙须菜(Gracilaria lemaneiformis)等。栉孔扇贝和牡蛎从每年5月开始进行养殖,养殖周期约为2年;海带在10月底至11月初开始挂苗,次年5—7月初完成收获(Sui et al, 2019)。
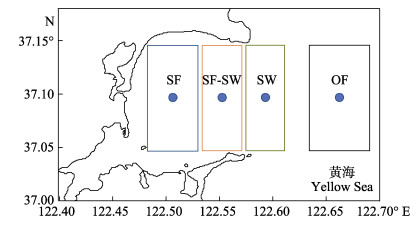
1.2 样品收集方法2022年8月在桑沟湾贝类养殖区(SF)、贝藻混养区(SF-SW)、藻类养殖区(SW)以及外海区(OF)分别取样,每个站位取3个平行样。在各养殖区中心取样,取样站位见图 1。取样地点的水深越浅,取样过程中温度和水压的变化对沉积物理化参数的影响越小,在水深相对较低的沿岸近海区域,非原位调查对沉积物理化参数分布的影响较小(Jørgensen et al, 2022),且已有文献报道显示,对于近岸海域调查,采用获取样品后立即监测的方法是可行的(Vopel et al, 2021; Wang et al, 2016; Glud, 2008)。因此,调查中使用箱式采泥器采集带有上覆水的沉积物样品,使用有机玻璃管收集带有上覆水的沉积物柱状样(Glud, 2008),在获取样品后立即进行测量。使用YSI EXO便携式多参数水质监测仪现场测定水温和盐度。
|
图 1 桑沟湾养殖布局及调查站位 Fig.1 Mariculture distribution and sampling stations of Sanggou Bay SF、SF-SW、SW和OF分别代表贝类区、贝藻区、藻类区以及外海区。下同。 SF, SF-SW, SW and OF represent the shellfish monoculture area, shellfish and seaweed polyculture area, seaweed monoculture area, and offshore area respectively. The same below. |
使用Unisense微电极(Unisense Microsensor Multimeter Version 2.01)测定沉积物–水界面的DO、pH和H2S微观剖面,空间分辨率为1 mm (Wang et al, 2016),每个样品进行3次重复测量,取平均值作为测定结果。以DO在沉积物中下降到0.1 mg/L的深度作为沉积物氧渗透深度(oxygen penetration depth, OPD) (Lin et al, 2021),以DO < 1 mg/L的深度作为沉积物低氧区的边界(Liao et al, 2022)。
沉积物样品经超声波振荡30 s进行均质后,使用激光粒度分析仪(Mastersizer 2000, Malven Instruments Ltd.英国)测定沉积物粒径。另取沉积物样品,分别测定湿重和干重,用于沉积物孔隙度的计算。取部分干燥后的样品研磨并通过0.15 mm网筛进行均质化,用盐酸酸化后,经超纯水洗涤至上清液呈中性。在60 ℃干燥后,称取约50 mg样品到锡舟中。使用元素分析仪(Vario EL cube, 德国)分析沉积物有机碳含量(sediment organic carbon, SOC),测量误差为0.01%。用于分析的所有沉积物样品进行3次重复测量,取平均值作为测定结果。
1.4 孔隙度、沉积物–水界面溶解氧扩散通量及沉积物耗氧率的计算孔隙度的计算公式如下:
| $ \varphi=\frac{\left(W_{\mathrm{W}}-W_{\mathrm{D}}\right)}{W_{\mathrm{W}}-W_{\mathrm{D}}+W_{\mathrm{D}} / 2.5} \times 100 \%$ | (1) |
式中,WW为样品湿重(g),WD为样品干重(g),2.5为表层沉积物平均密度与水密度比值。
在距离海床最近的区域内,水流受海底的影响显著,海水流动受到抑制,在更小的尺度上,海水的流速会急剧下降,在沉积物–水界面上方形成厚度约为0.1 mm到几毫米的水薄膜,这一界面构成了氧和其他溶解化合物交换的重要屏障,被称为扩散边界层(DBL),由于这一区域内水流流速显著降低,DBL中的物质输运主要由分子扩散作用控制。若DBL中没有DO的额外消耗和生成,DO浓度应从DBL上边界呈线性减小到沉积物–水界面处,由于沉积物孔隙度的影响,在DBL和沉积物中DO的扩散系数不同,因此,经过水–沉积物界面两侧DO曲线的斜率会发生明显的变化,可以根据DO剖面中线性分布的拐点确定沉积物–水界面的位置及DBL的厚度(汪嘉宁等, 2012)。基于通过DBL的DO微梯度,采用菲克第一定律计算沉积物–水界面溶解氧扩散通量(diffusion flux of O2) J [mg/(m2·s)] (Jørgensen et al, 2022):
| $ J = D \times ({C_{\text{W}}} - {C_0})/{x_{\text{d}}} $ | (2) |
式中,D为氧分子在水中的扩散系数,取值为2.3× 10–5 cm2 /s (Chester, 2009),CW为上覆水DO浓度(mg/L),C0为沉积物–水界面处的DO浓度(mg/L),Xd为DBL的厚度(mm)。
DO主要通过扩散形式渗透到沉积物中,在沉积物向深处扩散的过程中,各类微生物活动以及其代谢产物的氧化会持续消耗沉积物中的DO。当沉积物处于稳定状态时,沉积物中DO的扩散与消耗处于平衡状态,沉积物耗氧率(R) [mg/(cm3·s)]可通过如下公式计算(Berg et al, 1998):
| $R=\varphi D_{\mathrm{S}}\left(\frac{\mathrm{d}^2 C_{\mathrm{DO}}}{\mathrm{d} x^2}\right)$ | (3) |
式中,
氧分子在沉积物中的扩散系数DS (cm2 /s)通过如下公式计算(Wang et al, 2016):
| $ D_{\mathrm{S}}=\frac{D}{1+3(1-\varphi)} $ | (4) |
式中,
使用SPSS 16.0软件对不同区域水环境参数和沉积物耗氧率进行单因素方差分析(one-way ANOVA)以确定不同区域在95%置信水平上的统计学差异。对数据进行双尾显著检验的Pearson相关性分析以研究各区域沉积物耗氧率与上覆水DO、沉积物–水界面DO及DBL厚度之间的相关关系。根据特征根大于1确定主成分个数,根据载荷矩阵分析计算特征向量系数,根据DO渗透的范围对整个海区内沉积物耗氧率、DO扩散通量与沉积物表层0~1 cm范围内SOC、粒径应用主成分进行降维处理。
2 结果 2.1 桑沟湾沉积物上覆水的环境参数桑沟湾沉积物上覆水的环境参数如表 1所示。区域间的上覆水水温差异显著(P < 0.05),总体上为从湾内向湾外逐渐降低,贝类区上覆水水温高于其他区域,贝藻区上覆水水温低于贝类区,高于藻类区,藻类区上覆水水温显著低于其他区域,外海区上覆水水温显著高于藻类区(P < 0.05);区域间的上覆水盐度无显著性差异(P > 0.05);上覆水DO从湾内向湾外增高,外海区显著高于其他区域(P < 0.05),藻类区显著高于贝类区和贝藻区(P < 0.05),贝类区与贝藻区差异不显著(P > 0.05)。
|
|
表 1 桑沟湾调查站位水深以及沉积物上覆水环境参数 Tab.1 Water depth and sediment overlaying water environmental parameters of Sanggou Bay |
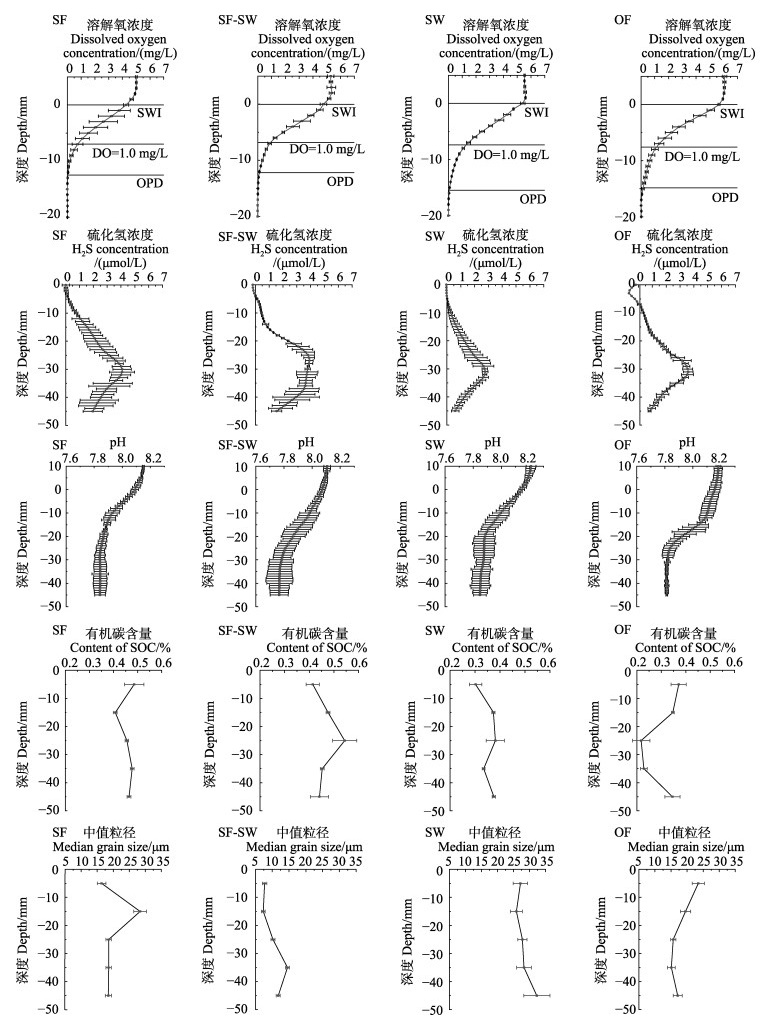
各区域沉积物理化参数的剖面分布见图 2。各区域内DO在沉积物表面快速下降到0,与pH分布呈显著正相关(P < 0.05)。H2S表现出随深度先增加后降低的趋势,pH随深度逐渐降低,在沉积物–20~–30 mm范围内趋于稳定。
|
图 2 不同区域沉积物中DO、H2S、pH、SOC含量以及中值粒径剖面分布 Fig.2 Profile distribution of dissolved oxygen concentration, H2S concentration, pH, content of SOC and median grain size in sediments from different areas SWI示沉积物–水界面,OPD示氧渗透深度。 SWI represents sediment-water interface; OPD represents oxygen penetration depth. |
贝类区SOC在–5~–15 mm范围内表现出减少趋势,随后在–15~–35 mm范围内表现出增加趋势,在–35~–45 mm范围内趋于稳定;贝藻区表现出随深度先增加后降低的趋势,在–25 mm处达到最大值;藻类区表现出随深度增加的趋势;外海区SOC在–15~–35 mm范围内表现出随深度降低的趋势,在–35~–45 mm范围内随深度逐渐增加。
贝类区沉积物粒径表现出先增加后降低的趋势,最大值出现在–15 mm处,–25~–45 mm范围内变化较小;贝藻区沉积物粒径在–5~–35 mm范围内随深度逐渐增加,在–35 mm处达到最大值,此后逐渐降低;藻类区沉积物粒径随深度逐渐增加;外海区沉积物粒径表现出随深度逐渐降低的趋势。贝类区、贝藻区、藻类区和外海区平均孔隙度分别为(69±2)%、(70±3)%、(63±4)%和(64±3)%。
4个区域(贝类区、贝藻区、藻类区及外海区)的低氧区(DO < 1 mg/L)分别出现在(6.97±0.95)、(6.82± 0.28)、(7.41±0.58)、(7.44±0.86) mm处,区域间差异不显著;氧渗透深度分别为(12.49±1.59)、(12.17± 0.09)、(15.49±0.79)、(14.87±1.27) mm,区域间差异显著(P < 0.05),贝类区与贝藻区氧渗透深度显著低于外海区和藻类区,贝类区与贝藻区差异不显著,藻类区与外海区差异不显著。
H2S分别在贝类区、贝藻区、藻类区和外海区(32.00± 2.16)、(28.30±0.94)、(31.00±0.82)、(29.70±1.25) mm处达到最大值,各区域H2S最大浓度分别为(5.73± 0.04)、(4.80±0.08)、(3.30±0.19)、(3.97±0.38) μmol/L,区域间差异显著,贝类区显著高于其他区域,贝藻区高于藻类区和外海区,外海区显著高于藻类区(P < 0.05)。
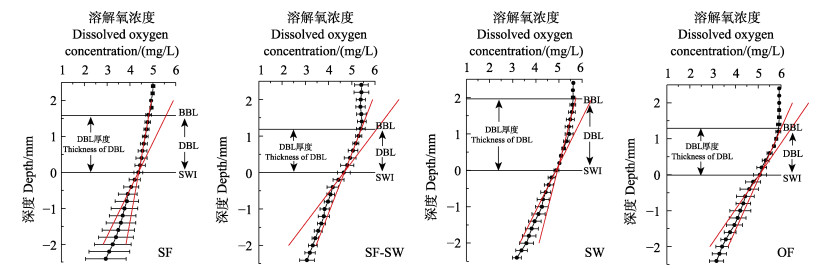
2.3 沉积物溶解氧消耗各区域沉积物中,DBL厚度及沉积物–水界面(SWI)位置如图 3所示。各区域DBL厚度分别为(1.5±0.3)、(1.0±0.3)、(2.0±0.8)、(1.3±0.2) mm,区域间差异不显著(P > 0.05)。
|
图 3 不同区域溶解氧浓度在扩散边界层(DBL)、沉积物–水界面(SWI)和沉积物中的剖面分布 Fig.3 Profile distribution of dissolved oxygen concentration in diffusion boundary layer (DBL) and sediment-water interface (SWI) in sediment from different areas BBL表示底边界层。 BBL represents the bottom boundary layer. |
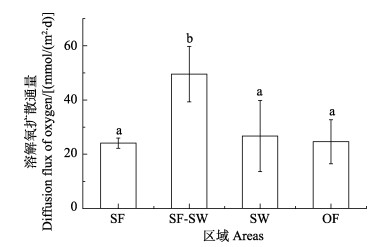
4个区域的平均DO扩散通量分别为(24.10±1.89)、(49.53±10.24)、(26.69±13.13)、(24.79±7.95) mmol/(m2·d),其中,贝藻区DO扩散通量显著高于其他区域(P < 0.05),其他区域之间差异不显著(见图 4)。
|
图 4 桑沟湾沉积物–水界面溶解氧扩散通量 Fig.4 Diffusion flux of oxygen in sediment-water interface in Sanggou Bay |
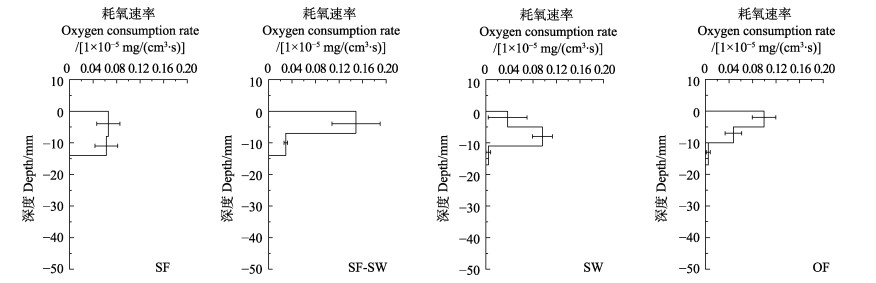
不同区域沉积物耗氧率剖面分布如图 5所示。各区域沉积物平均耗氧率分别为(0.078±0.013)×10–5、(0.141±0.024)×10–5、(0.066±0.010)×10–5、(0.072±0.005) ×10–5 mg/(cm3·s),其中,贝藻区沉积物耗氧率显著高于其他区域(P < 0.05),其他区域之间差异不显著。
|
图 5 不同区域沉积物耗氧率剖面分布 Fig.5 Profile distribution of oxygen consumption rate in sediment from different areas |
4个区域沉积物–水界面DO扩散通量和沉积物耗氧率与环境因子之间的相关性见表 2。
|
|
表 2 沉积物–水界面溶解氧扩散通量和沉积物耗氧率与环境因子之间的相关系数 Tab.2 The Pearson correlation coefficients of sediment oxygen consumption rate, diffusion flux of oxygen in sediment-water interface and environmental factors in different areas |
各区域沉积物–水界面DO扩散通量与沉积物耗氧率呈显著正相关关系(P < 0.05),与沉积物上覆水DO呈正相关关系,与沉积物–水界面DO呈负相关关系;沉积物耗氧率与沉积物–水界面DO呈负相关关系;沉积物–水界面DO扩散通量以及沉积物耗氧率均与DBL的厚度成负相关关系。其中,贝类区沉积物耗氧率与沉积物–水界面处DO浓度呈显著负相关关系(P < 0.05),贝藻区沉积物耗氧率与沉积物水界面处DO浓度呈极显著负相关关系(P < 0.01),贝藻区和藻类区DO扩散通量与上覆水DO呈显著正相关关系(P < 0.05)。外海区DO扩散通量与上覆水DO的相关性不显著(P > 0.05)。
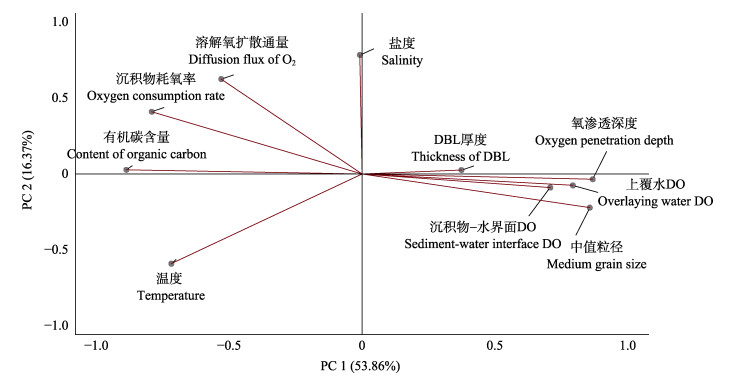
沉积物化学特征及环境因子的主成分分析(principal component analysis, PCA)结果如图 6所示。应用PCA对数据进行降维处理,经计算KMO值(Kaiser-Meyer-Olkin)为0.516,大于0.5,表明所用数据可用于PCA。经Bartlett球形度检验,近似卡方值为137.111 (P < 0.01),结果表明,因子之间的相关性显著。利用特征值大于1的原则选择前2个主成分,累计方差贡献率为70.23%,主成分1主要表征SOC含量、氧渗透深度、上覆水DO以及沉积物–水界面DO,总方差贡献率为53.86%,主成分2主要表征沉积物–水界面DO扩散通量、沉积物耗氧率、粒径、温度及盐度,总方差贡献率为16.37%。结果表明,海区内沉积物–水界面DO扩散通量与沉积物耗氧率呈显著正相关关系(P < 0.05);沉积物耗氧率与SOC呈正相关关系,与粒径大小和沉积物界面处DO呈负相关关系(P < 0.05)。沉积物氧渗透深度与SOC、沉积物耗氧率呈负相关关系,与粒径和上覆水DO呈正相关关系(P < 0.05)。
|
图 6 桑沟湾沉积物化学特征及环境因子PCA排序图 Fig.6 Principal component analysis (PCA) biplot of environmental factors and chemical characteristics of sediments from Sanggou Bay |
众所周知,沉积物内部DO的消耗过程是受到多种因素共同影响的复杂过程,海水DO含量、温度、有机碳输入、无机代谢产物的氧化以及沉积物粒径等因素都会对沉积物微环境产生影响(Jørgensen et al, 2022; Wieland et al, 2000)。在近海养殖海域中,养殖活动带来的有机质富集是DO消耗的主要原因。
因为该区域的水动力条件会在养殖设施的影响下被削弱,加之养殖区内大量养殖生物的活动,导致养殖区沉积物中有机质大量富集。微生物分解有机质的过程会消耗大量的底层DO。因此,在近岸水产养殖区中,尤其是其底栖环境中,更容易发生DO降低的现象。根据本研究和文献报道,沉积物耗氧总体上表现出从深海到近岸逐渐增加的趋势,而在近岸海域,养殖区DO消耗速率要远高于未进行养殖的近岸区域(表 3),这表明养殖活动带来的生物沉积作用对沉积物耗氧率的影响是显而易见的,是沉积物耗氧加剧的重要原因。
|
|
表 3 不同区域的沉积物耗氧率比较 Tab.3 Comparison of sediment oxygen consumption rates of different areas |
桑沟湾各调查区域主要养殖方式为筏式养殖,其中,贝类区以单养长牡蛎为主,贝藻区以长牡蛎和海带混养为主,藻类区以单养海带为主。桑沟湾海域内沉积物耗氧率在全球近岸海域范围内处于较高水平,与国内几个著名的水产养殖区相比,桑沟湾沉积物耗氧率要高于以底播贝类养殖为主的胶州湾,并远低于以网箱养殖为主的大鹏澳养殖区。与筏式贝藻养殖相比,网箱养殖不仅会影响区域内的水动力条件,养殖过程中的投饵和鱼类相较于贝类更强烈的生理活动都加速了网箱养殖带来的有机质沉积,因此,网箱养殖区的沉积物耗氧更剧烈。相比之下,底播贝类养殖虽然也会带来生物沉积作用,但是缺少了筏架等养殖设施的影响,水流速度相对较快,更容易将原本沉积到海底的有机质再悬浮,因此,底播贝类养殖区沉积物的耗氧率相对较弱。不同养殖区(不同养殖模式)沉积物耗氧率的差异也表明,不同养殖活动生物沉积作用的不同会对沉积物有机质含量带来较大影响,并进一步影响沉积物的耗氧率。
但即使同属于筏式养殖,大型藻类和双壳贝类不同物种之间生理活动的差异同样导致了生物沉积作用的差异。本研究中,贝藻混养区沉积物有机碳含量最高,由于贝类生物沉积作用要强于藻类(Pan et al, 2021),因此,贝类养殖区沉积物的有机碳含量要高于藻类养殖区。沉积物耗氧率与沉积物有机碳含量呈显著正相关关系,相应地,贝藻混养区沉积物的DO消耗速率最快,贝类区次之。但是需要注意的是,本研究发现,藻类养殖区表层沉积物有机碳的含量反而低于外海区,根据何宇晴等(2016)对桑沟湾水动力的研究发现,藻类养殖区所处的桑沟湾湾口的海流方向呈往复流,并且在湾口区域,海流的速度有明显加快的变化规律,因此可以推测,藻类养殖过程中产生的碎屑等生物沉积物在海流的作用下被输送到外海区,造成了该区域沉积物的有机碳含量要高于藻类区,从而加速了外海区沉积物DO的消耗。另外,不能忽视的是,外海区沉积物能够富集更多的有机质与沉积物粒径大小也有直接关系。沉积物颗粒越小越容易富集有机物(Franzo et al, 2014)。与藻类区沉积物粒径结构相比,外海区的沉积物粒径更小,因此,沉积物粒径大小的差异也是另一个造成外海区沉积物有机碳含量高于藻类区的原因。不仅如此,沉积物DO的分布也与底质类型有关(Glud, 2008)。DO在沉积物中的渗透深度与沉积物粒径成正比,DO更容易在粒径较大的沉积物中扩散(Hicks et al, 2017)。相比于外海区,贝类区内平均氧渗透深度减少了2.38 mm,贝藻区减少了2.70 mm,藻类区却比外海区高出0.62 mm。由于藻类养殖区沉积物的粒径明显高于其他区域,因此,藻类区沉积物更不容易富集有机质的同时,DO的渗透深度更深。
在沉积环境中,有机质会在硫酸盐还原菌作用下生成硫化物,由于硫化物易被氧化,因此,在富氧水中硫化物几乎不存在,而在沉积物的低氧环境中硫化物含量较高。当沉积物DO被持续消耗,沉积物从氧化状态开始向着还原状态转变。在还原条件下,沉积物中的硫化物开始转化为H2S,并从沉积物内部向底层水体释放。因此,H2S浓度的升高通常都伴随着DO浓度降低。本研究中,H2S浓度最高的区域也对应着DO消耗最快的区域。另外,由于H2S极易氧化,其释放会加剧DO的消耗(Kodama et al, 2018),进一步促进了沉积物向还原条件转化。这也解释了沉积物中H2S浓度与沉积物耗氧率呈显著正相关关系的原因,同时,H2S浓度也与沉积物中氧渗透深度呈显著负相关关系。结果表明,沉积物有机碳除直接影响了沉积物中微生物有氧呼吸耗氧外,还通过释放H2S等耗氧物质的方式,间接加速了沉积物耗氧过程。从H2S的剖面分布来看,4个区域沉积物中H2S分别在约(32.00±2.16)、(28.30±0.94)、(31.00±0.82)、(29.70± 1.25) mm达到最大值,随后呈下降趋势,其中,贝藻区沉积物中,在28~36 mm范围内H2S浓度下降速度较慢,仍然表现为较高水平,在约36 mm处才开始表现出快速下降的趋势。H2S浓度与pH密切相关,表层pH表现出快速下降的趋势,各区域pH分别约在(27.00±0.82)、(25.00±1.41)、(28.00±0.81)和(26.00± 0.47) mm处达到最低值。在氧化状态下,沉积物中的有机质被氧化分解,消耗间隙水中的DO的同时向间隙水中释放H+,这可能是表层沉积物DO以及pH下降的主要原因(Wang et al, 2016)。但在沉积物中DO耗尽后,pH仍然表现出随深度降低的趋势,从pH达到最低值的位置来看,这一位置与H2S达到峰值的位置接近,这一结果表明,还原状态下H2S的产生和释放可能是沉积物中pH继续降低的原因。同时,H2S含量的升高也使得沉积物中pH的浓度进一步下降,这可能是贝藻区沉积物pH表现出最低值的原因。通常情况下,当pH=8时,H2S会更加稳定,因此,H2S含量的升高基本接近pH=8的深度附近,而pH会随着沉积物的深度增加而降低,H2S在pH < 8的情况下并不稳定,更容易转化为其他形态而存在。另外,H2S气体在生成后会随着间歇水向沉积物表层扩散,并最终扩散到上覆水中。由于H2S极易氧化,因此在O2含量较为充足的表层和上覆水中,H2S含量较低(Jørgensen et al, 2019),这可能是H2S表现出峰值区间深度的原因。
综上所述,贝类养殖产生的生物沉积对沉积物微环境的影响更为显著,而相比之下,藻类碎屑对沉积物微环境的影响较弱。此外,研究表明,沉积物有机质的富集不利于底栖生物的生长(Yang et al, 2018)。随着有机质在沉积物中的富集,沉积物中有氧区范围表现出减少的趋势,这些变化对沉积物中H2S的产生和释放有促进作用,可能会进一步加剧有机质对沉积物微环境的影响。而对低氧和H2S具有很强耐受性的底栖生物(如多毛类),其生存活动中的挖掘行为往往有助于沉积物中DO的渗透(Jørgensen et al, 2022),因此,未来或可在养殖体系中加入此类底栖生物以改善沉积物中溶氧的渗透,减弱养殖体系对沉积物微环境的影响。
3.2 不同区域沉积物–水界面溶解氧通量的主要影响因素调查结果显示,各区域之间上覆水水温的差异主要由水深引起,研究指出,一定范围(0~25 ℃)内温度的升高对沉积物中耗氧过程有促进作用(Jørgensen et al, 2022)。此前也有研究表明,20~25 ℃范围内小幅度升温对沉积物耗氧的影响并不显著(郑旻等, 2023; 张学雷等, 2006)。本研究调查结果显示,各区域温度在21.8~23.66 ℃范围内,温差变化较小,因此,夏季不同区域上覆水的水温差异可能不是各区域沉积物耗氧产生的差异的主要原因。研究证明,在类似的有机质含量较高的海域中,上覆水DO浓度较高会加速沉积物的耗氧(Meier et al, 2018),这也证明了研究的调查结果,对于养殖海区,沉积物–水界面DO扩散通量的主要影响因素为上覆水DO浓度。但本研究显示,不同养殖区DO扩散通量存在差异,贝藻混养区的DO扩散通量显著高于其他区域,而其他区域之间的DO扩散通量差异不显著。调查结果显示,贝类区沉积物–水界面DO扩散通量与其他环境因子之间的相关性不显著,而藻类区、贝藻区沉积物–水界面DO扩散通量与上覆水DO呈显著正相关关系,这可能表明,沉积物–水界面上的扩散通量同时受上覆水DO、DBL厚度及沉积物–水界面DO等多种因素综合作用影响。
研究指出,DBL的存在影响了通过沉积物–水界面处的物质交换,限制了DO通过沉积物–水界面(Rasmussen et al, 1992)。在DBL内,影响沉积物–水界面DO扩散通量的因素为沉积物上覆水DO浓度、沉积物–水界面DO浓度以及DBL厚度,DBL厚度越低,物质在DBL中的扩散速率越快(Jørgensen et al, 2022)。结果显示,沉积物–水边界上的DO浓度与沉积物耗氧率呈显著负相关关系,这表明沉积物内的耗氧过程消耗了沉积物表层的DO,改变了沉积物–水界面的DO浓度,进而影响了通过DBL的DO浓度梯度。根据汪嘉宁等(2012)的研究,通过DBL的DO通量与沉积物耗氧率成正比,这也证实了本研究的结果,沉积物内的耗氧通过影响沉积物–水界面处的DO浓度进而影响沉积物–水界面DO扩散通量变化。贝类区和贝藻区SOC含量较高,相应的沉积物耗氧率较高,因此,对沉积物–水界面DO浓度的影响显著,这解释了贝类区和贝藻区沉积物–水界面DO与沉积物耗氧率呈显著负相关关系的原因。研究指出,DBL厚度与沉积物表面的粗糙程度有关,表层沉积物粒径越大,DBL越厚(Han et al, 2018),较厚的边界层会对沉积物–水界面处的物质扩散起到阻碍作用。由于贝类区沉积物粒径相对较大,使得这一区域内DBL厚度较厚,在一定程度上抵消了其他因素的影响,这可能是贝类区沉积物–水界面DO扩散通量与其他因素相关性不显著的原因。
从影响沉积物耗氧的因素来看,海区内沉积物的有机质含量是影响沉积物耗氧的重要原因,由于水动力以及养殖活动的影响,贝类区和贝藻区有机碳含量较高,加速了沉积物耗氧,而贝类区DBL厚度较高,抵消了有机质增加的影响,而贝藻区沉积物粒径较小,DBL厚度较低,沉积物耗氧的影响更显著。同时,也有研究表明,海藻产生的有机碎屑可能会扩散到其他区域(杨冠林等, 2022),这一过程可能增加了外海区沉积物中的有机质含量,且本研究中藻类区、外海区沉积物有机碳含量以及粒径也较为接近,这可能是藻类区与外海区差异不显著的原因。
微生物有氧呼吸耗氧是海底沉积物耗氧的主要途径,同时,海底耗氧量也包括了有机质代谢过程中产生的无机代谢产物氧化消耗的O2。在厌氧矿化过程中,一些参与有机质厌氧矿化的电子受体被还原后最终未被O2氧化,而是在微生物作用下形成如硫化物等代谢产物的埋藏(Canfield et al, 2005)。在将海底耗氧量转换为有机碳矿化速率时,这部分未被完全氧化的量与有机质降解产物(如NH4+等)部分氧化的耗氧量较为接近,计算时几乎可以相互抵消(Glud, 2008),因此,可通过测量沉积物–水界面DO扩散通量来表征沉积物中有机碳的矿化速度(郑旻等, 2023)。据此推测,桑沟湾养殖区域内沉积物中有机碳矿化主要受沉积物上覆水DO的影响,沉积物DBL厚度影响了沉积物–水界面上的物质交换,间接影响了沉积物中有机碳的矿化速率。此外,贝藻养殖产生的生物沉积影响了沉积物耗氧率,继而影响了沉积物–水界面处的DO浓度,从而间接对沉积物矿化速率产生影响。
4 结论与自然海区相比,养殖活动产生的生物沉积促进了沉积物中DO的消耗,使得沉积物从氧化状态向还原条件转化,这也促进了H2S在沉积物中的产生和释放,生成的H2S进一步加速了沉积物中DO的消耗。不同养殖区的结果对比表明,贝类养殖产生的生物沉积对沉积物微环境的影响要大于藻类养殖产生的生物碎屑的影响。结果显示,贝类区沉积物–水界面DO扩散通量受上覆水DO、DBL厚度及水–沉积物界面DO的共同影响,藻类区和贝藻区沉积物–水界面DO扩散通量主要影响因素为沉积物上覆水DO。据此推测,养殖海区内影响沉积物有机碳矿化的主要因素为上覆水DO。调查结果表明,养殖活动产生的生物沉积显著影响了沉积物–水界面以及表层沉积物的物质循环。
BERG P, RISGAARD-PETERSEN N, RYSGAARD S. Interpretation of measured concentration profiles in sediment pore water. Limnology and Oceanography, 1998, 43(7): 1500-1510 DOI:10.4319/lo.1998.43.7.1500 |
BREITBURG D, LEVIN L A, OSCHLIES A, et al. Declining oxygen in the global ocean and coastal waters. Science, 2018, 359(6371): eaam7240 DOI:10.1126/science.aam7240 |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2022. Beijing: China Agriculture Press, 2022 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2022中国渔业统计年鉴. 北京: 中国农业出版社, 2022]
|
CANFIELD D E, KRISTENSEN E, THAMDRUP B. Aquatic geomicrobiology. In: SOUTHWARD A J, TYLER P A, YOUNG C M, et al. Advances in marine biology. London: Elsevier, 2005, 270–276
|
CHAI Z Q, LI R H, NING Z M, et al. Effects of aquaculture activities on nutrients and phytoplankton composition: A case study of Sanggou Bay mesocosm experiment. Periodical of Ocean University of China, 2022, 52(6): 92-102 [柴正晴, 李瑞环, 宁志铭, 等. 水产养殖活动对水体营养盐及浮游植物组成的影响——以桑沟湾围隔实验为例. 中国海洋大学学报(自然科学版), 2022, 52(6): 92-102] |
CHESTER R. Marine geochemistry. John Wiley and Sons, 2009
|
FRANZO A, CIBIC T, DEL NEGRO P, et al. Microphytobenthic response to mussel farm biodeposition in coastal sediments of the northern Adriatic Sea. Marine Pollution Bulletin, 2014, 79(1/2): 379-388 |
FUCHSMAN C A, DEVOL A H, CHASE Z, et al. Benthic fluxes on the Oregon shelf. Estuarine, Coastal and Shelf Science, 2015, 163: 156-166 DOI:10.1016/j.ecss.2015.06.001 |
GLUD R N, BERG P, THAMDRUP B, et al. Hadal trenches are dynamic hotspots for early diagenesis in the deep sea. Communications Earth and Environment, 2021, 2(1): 21 DOI:10.1038/s43247-020-00087-2 |
GLUD R N. Oxygen dynamics of marine sediments. Marine Biology Research, 2008, 4(4): 243-289 DOI:10.1080/17451000801888726 |
HAN X, FANG H W, HE G J, et al. Effects of roughness and permeability on solute transfer at the sediment water interface. Water Research, 2018, 129: 39-50 DOI:10.1016/j.watres.2017.10.049 |
HE Y Q, HUANG D J, ZENG D Y, et al. Effect of suspended kelp culture on vertical structure of tidal current in Sanggou Bay. Journal of Marine Sciences, 2016, 34(4): 20-27 [何宇晴, 黄大吉, 曾定勇, 等. 桑沟湾筏式海带养殖对潮流垂直结构的影响. 海洋学研究, 2016, 34(4): 20-27] |
HICKS N, UBBARA G R, SILBURN B, et al. Oxygen dynamics in shelf seas sediments incorporating seasonal variability. Biogeochemistry, 2017, 135: 35-47 DOI:10.1007/s10533-017-0326-9 |
JøRGENSEN B B, FINDLAY A J, PELLERIN A. The biogeochemical sulfur cycle of marine sediments. Frontiers in Microbiology, 2019, 10: 849 DOI:10.3389/fmicb.2019.00849 |
JØRGENSEN B B, WENZHÖFER F, EGGER M, et al. Sediment oxygen consumption: Role in the global marine carbon cycle. Earth-Science Reviews, 2022, 228(Suppl C): 103987 |
KODAMA K, WAKU M, SONE R, et al. Ontogenetic and temperature-dependent changes in tolerance to hypoxia and hydrogen sulfide during the early life stages of the Manila clam Ruditapes philippinarum. Marine Environmental Research, 2018, 137: 177-187 DOI:10.1016/j.marenvres.2017.12.019 |
LEMBURG J, WENZHöFER F, HOFBAUER M, et al. Benthic crawler NOMAD//2018 OCEANS-MTS/IEEE Kobe Techno- Oceans (OTO). IEEE, 2018, 1-7 |
LIAO K, MA S, LIU C, et al. High concentrations of dissolved organic nitrogen and N-nitrosodimethylamine precursors in effluent from biological nutrient removal process with low dissolved oxygen conditions. Water Research, 2022, 216: 118336 DOI:10.1016/j.watres.2022.118336 |
LIN X L, EGUCHI S, MAEDA S, et al. Combined effects of oxygen and temperature on nitrogen removal in a nitrate-rich ex-paddy wetland. Science of the Total Environment, 2021, 779: 146254 DOI:10.1016/j.scitotenv.2021.146254 |
LIU Y, WANG X M, WU W G, et al. Experimental study of the environmental effects of summertime cocultures of seaweed Gracilaria lemaneiformis (Rhodophyta) and Japanese scallop Patinopecten yessoensis in Sanggou Bay, China. Fishes, 2021, 6(4): 53 DOI:10.3390/fishes6040053 |
LOMSTEIN B, BLACKBURN T H. Sediment nitrogen cycling in Aarhus Bay, Denmark. Miljoministeriet, Copenhagen, 1992
|
MEIER H E M, VäLI G, NAUMANN M, et al. Recently accelerated oxygen consumption rates amplify deoxygenation in the Baltic Sea. Journal of Geophysical Research: Oceans, 2018, 123(5): 3227-3240 DOI:10.1029/2017JC013686 |
GLUD R N, GUNDERSEN J K, JORGENSEN B B, et al. Diffusive and total oxygen uptake of deep-sea sediments in the eastern South Atlantic Ocean: In situ and laboratory measurements. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 1994, 41(11/12): 1767-1788 |
PAN Z, TAN Y M, GAO Q F, et al. A 120-year record of burial fluxes and source apportionment of sedimentary organic carbon in Alian Bay, China: Implication for the influence of mariculture activities, and regional environment changes. Aquaculture, 2021, 535: 736421 DOI:10.1016/j.aquaculture.2021.736421 |
QIAO S B, LIN Q. Preliminary study on sediment oxygen demand of marine cage aquaculture in Dapeng´ao Bay. South China Fisheries Science, 2006, 2(3): 32-39 [乔士斌, 林钦. 大鹏澳网箱养殖区沉积物耗氧的初步研究. 南方水产, 2006, 2(3): 32-39] |
RASMUSSEN H, JøRGENSEN B B. Microelectrode studies of seasonal oxygen uptake in a coastal sediment: Role of molecular diffusion. Marine Ecology Progress Series, 1992, 81(3): 289-303 |
SUI J J, ZHANG J H, REN S J, et al. Organic carbon in the surface sediments from the intensive mariculture zone of Sanggou Bay: Distribution, seasonal variations and sources. Journal of Ocean University of China, 2019, 18(4): 985-996 DOI:10.1007/s11802-019-3768-y |
SUN W, ZHANG J H, WU W G, et al. Carbon footprint assessment of cultured kelp based on life cycle assessment. Progress in Fishery Sciences, 2022, 43(5): 16-23 [孙威, 张继红, 吴文广, 等. 基于生命周期法的养殖海带的碳足迹评估. 渔业科学进展, 2022, 43(5): 16-23] |
VOPEL K, LAVEROCK B, CARY C, et al. Effects of warming and CO2 enrichment on O2 consumption, porewater oxygenation and pH of subtidal silt sediment. Aquatic Sciences, 2021, 83: 8 DOI:10.1007/s00027-020-00765-5 |
WANG J N, ZHAO L, WEI H. Variable diffusion boundary layer and diffusion flux at sediment-water interface in response to dynamic forcing over an intertidal mudflat. Chinese Science Bulletin, 2012, 57(8): 656-665 [汪嘉宁, 赵亮, 魏皓. 潮滩动力过程影响下扩散边界层和沉积物–水界面扩散通量的变化. 科学通报, 2012, 57(8): 656-665] |
WANG J F, CHEN J A, DAI Z H, et al. Microscale chemical features of sediment-water interface in Hongfeng Lake. Journal of Earth Science, 2016, 27: 1038-1044 DOI:10.1007/s12583-015-0618-8 |
WIELAND A, KÜHL M. Irradiance and temperature regulation of oxygenic photosynthesis and O2 consumption in a hypersaline cyanobacterial mat (Solar Lake, Egypt). Marine Biology, 2000, 137: 71-85 DOI:10.1007/s002270000331 |
YANG G L, LIN J, ZHANG S Y, et al. Study on offshore transport of organic detritus in seaweed field based on Lagrange method. Progress in Fishery Sciences, 2022, 43(5): 49-60 [杨冠林, 林军, 章守宇, 等. 基于拉格朗日法的海藻场有机碎屑离岸输运研究. 渔业科学进展, 2022, 43(5): 49-60] |
YANG S, YANG Q, SONG X L, et al. A novel approach to evaluate potential risk of organic enrichment in marine aquaculture farms: A case study in Sanggou Bay. Environmental Science and Pollution Research, 2018, 25(17): 16842-16851 DOI:10.1007/s11356-018-1828-2 |
ZHANG X L, ZHU M Y, CHEN S. Study on sediment oxygen consumption rate in the Sanggou Bay and Jiaozhou Bay. Advances in Marine Science, 2006, 24(1): 91-96 [张学雷, 朱明远, 陈尚. 桑沟湾和胶州湾沉积物耗氧率研究. 海洋科学进展, 2006, 24(1): 91-96] |
ZHENG M, LUO M, PAN B B, et al. Research progress of oxygen consumption in marine sediments. Advances in Earth Science, 2023, 38(3): 236 [郑旻, 罗敏, 潘彬彬, 等. 海洋沉积物溶解氧消耗研究进展. 地球科学进展, 2023, 38(3): 236] |



