2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业与可持续发展重点实验室 山东 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Marine Fisheries and Sustainable Development, Ministry of Agriculture and Rural Affairs, Qingdao 266071, China
刺参(Apostichopus japonicus)又名仿刺参,被列为“海产八珍”之一,具有较高的食用及药用价值,是我国北方地区重要的海水养殖品种之一。2022年,全国海参养殖面积达25.07万hm2,养殖产量为24.85万t(农业农村部渔业渔政管理局等, 2023)。其规模化养殖主要集中在辽宁、山东和福建霞浦等地(李成华, 2021),已形成了浅海底播增殖、池塘养殖、围堰养殖、工厂化养殖、浅海网箱养殖和海上吊笼养殖等多元化养殖模式(杨红生等, 2020)。浅海网箱养殖是近年来发展较快的刺参养殖模式,已成为大规格苗种培育和成参养殖的主要模式之一。据不完全统计,浅海小网箱的规模已经超过300万口,其中,辽宁省大连是主要的网箱养殖地区。目前,关于网箱养殖的研究报道较少,主要涉及海上网箱育苗及网箱中间培育方面(陈明强等, 2015; 盛伟博, 2022; 王吉桥等, 2011),而网箱养殖相关的养殖密度、投喂工艺以及养殖管理等技术还不完善。北方地区刺参网箱养殖主要采用不投饵及利用天然饵料的养殖模式,存在营养不足、养殖密度小和产量不高等问题。
养殖密度直接影响养殖产出,被认为是水产养殖中重要影响因素之一(Yuan et al, 2018)。国内外关于养殖密度对鱼、虾类等水产动物的影响研究较多,养殖密度过高往往会导致水产养殖生物成活率和生长率的显著下降(Costa et al, 2016; Yuan et al, 2018; Mahmoud et al, 2021),这可能与高密度养殖造成的水质不良以及种群内个体对饵料、空间等资源竞争加剧导致的应激胁迫有关(El-Khaldi, 2010)。高密度应激胁迫会引起养殖对虾摄食、生理、能量代谢及免疫功能等一系列变化(Ebrahimi et al, 2010; Liu et al, 2018; Wang et al, 2018; Mahmoud et al, 2021)。此外,养殖密度会对水产动物消化酶活性以及肠道菌群产生影响(Wang et al, 2018; Du et al, 2019)。Liu等(2018)和Adineh等(2019)研究发现,拥挤胁迫导致了罗非鱼(Oreochromis niloticus)、鲤(Cyprinus carpio)等消化酶活性显著下降;金头鲷(Sparus aurata)在高养殖密度条件下,肠道微生物发生了一定程度的改变(Parma et al, 2020);团头鲂(Megalobrama amblycephala)肠道微生物可能参与鱼类对拥挤胁迫的反应而发生了显著改变(Du et al, 2019)。在刺参养殖密度方面,通过室内养殖实验研究发现,刺参密度与生长的关系符合阿利氏群聚原则,即刺参的生长率随着养殖密度的升高而降低,而个体生长差异程度随着养殖密度的升高而增大(Dong et al, 2010; Pei et al, 2014)。目前,刺参网箱养殖密度仍以经验密度为主,缺乏科学规范的投放养殖方法,产出差异较大,经济效益不稳定(吴艳庆等, 2016)。此外,浅海网箱养殖中投喂人工配合饲料正悄然兴起,但配合饲料投喂方式下的养殖密度尚不清楚。
本研究拟在现有刺参网箱养殖模式的基础上,以课题组研制的海参片状饲料为基础,探讨片状饲料投喂条件下,不同养殖密度对浅海网箱养殖刺参生长、消化酶及肠道菌群的影响,以期为浅海网箱健康高效养殖提供科学依据。
1 材料与方法 1.1 实验地点与材料养殖网箱位于辽宁省大连市打连岛附近海域,养殖网箱规格为4 m⊆4 m⊆3 m,网衣为5目聚乙烯网(图 1)。刺参苗种由大连旭笙海产有限公司提供,选取同一批次、生长状况良好、活力较强、摄食正常的网箱养殖大规格苗种,苗种处于培育至成参的阶段,平均规格为(75.11±2.99) g。饲料主要原料为鱼粉、发酵豆粕粉、海带粉、紫菜粉、螺旋藻粉、藻胶粘合剂、多种维生素、多种矿物质元素和复合益生菌等。

|
图 1 刺参浅海养殖网箱 Fig.1 Net-cages for shallow-sea culture of sea cucumber A. japonicus |
刺参苗种在实验网箱暂养3 d后,随机分为3个组,即F10、F20和F30组,分别按10、20、30 kg/箱投放苗种,每组3个重复,实验日期为2022年10月6日―11月17日,共42 d。饲料为本实验室研制的片状饲料,通过手工泼洒使其尽量均匀分布在网箱底部,初始投喂量为刺参总重的1%,每2 d投喂1次。投喂次数和投喂量根据摄食情况、天气情况等适当调整,每日观察刺参生长及摄食情况并进行记录,养殖20 d时更换网衣一次。实验期间,水温为11.1~18.5 ℃,盐度为29.12~30.48,溶解氧(DO)为7.32~10.73 mg/L,pH为8.20~8.61。
1.3 样品采集实验结束时,称量每个网箱的刺参总重量,同时,每个网箱随机取20~30头刺参,吸干水分后称量每个体重及总重(精度为0.01 g),解剖去除内脏后称量体壁重。每个网箱随机取3头刺参,使用洁净的手术刀进行解剖,将肠道内容物轻轻挤出,整肠分割为小段,随机分装于无菌离心管,液氮冷冻后于–80 ℃超低温冰箱保存,用于消化酶活性的测定、肠道菌群结构的检测。
1.4 生长情况测定| $\begin{aligned} &\text { 增重率(weight gain rate, WGR, %) }\\ &\ \ \ \ \ \ \ \ \ \ \ =100 \times\left(W_t-W_0\right) / W_0 \end{aligned}$ | (1) |
| $\begin{aligned} &\text { 特定生长率(specific growth rate, SGR, %/d) }\\ &\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ =\left(\ln W_t-\ln W_0\right) / t \end{aligned}$ | (2) |
| $\begin{aligned} &\text { 出皮率(body wall production rate, BWR, %) }\\ &\ \ \ \ \ \ \ \ \ \ \ \ =100 \times W_{\mathrm{w}} / W_{\mathrm{b}} \end{aligned}$ | (3) |
| $\text { 饵料系数(feed conversion ratio, } \mathrm{FCR})=\mathrm{FC} /\left(W_\iota-W_0\right) \text {; }$ | (4) |
式中,W0为刺参的初始总重(g),Wt为刺参的终末总重(g),t为养殖实验天数(d),Ww为体壁重(g),Wb为体重(g),FC为饲料投喂总量(g)。
1.5 消化酶活性测定采用南京建成生物工程研究所有限公司的试剂盒测定肠道胰蛋白酶、脂肪酶和淀粉酶活性,试剂盒货号分别为A080-2-2、A054-2-1和C016-1-1,测定方法参照说明书。
1.6 肠道菌群结构分析细菌16S rRNA V3~V4片段的扩增引物为338F (5ʹ-ACTCCTACGGGAGGCAGCA-3ʹ)和806R(5ʹ-GGACTACHVGGGTWTCTAAT-3ʹ),应用Illumina Novaseq测序平台完成序列测序。对原始数据进行拼接、过滤和去除嵌合体等多个数据处理过程后最终获得有效序列。采用QIIME2软件对样品序列进行多样性分析,其中,Alpha多样性分析包括ACE指数、Chao1指数、Shannon指数和Simpson指数的分析;基于物种分类结果,得到在不同水平上各Rank的丰度值,采用STAMP软件比较样本或组间丰度差异,构建基于门和科的物种分布图。基于物种分类结果对不同养殖密度刺参肠道样品进行LEfSe分析,构建差异菌群物种信息树状图,在LDA判别值>3.5的判定标准下,筛选在不同养殖密度组中存在显著差异(P < 0.05)的菌群。在属分类水平上与消化酶活性变化进行皮尔森(Pearson)相关分析,筛选相关性绝对值>0.1且P < 0.05的数据构建相关性热图。高通量测序分析由北京百迈客生物科技有限公司(青岛)完成,数据分析利用百迈客云平台(https://www.biocloud.net/)完成。
1.7 数据处理与分析采用SPSS16.0软件对数据进行单因素方差分析(one-way ANOVA),采用Duncan多重比较分析不同处理组间的差异显著性,P < 0.05为差异显著水平,所有数值均采用平均值±标准差(Mean±SD)表示。
2 结果与分析 2.1 生长情况从表 1可以看出,实验结束时,F10组的WGR、SGR最高,分别为(51.63±4.72)%、(0.98±0.08) %/d,显著高于F20组与F30组(P < 0.05);净产量随着密度的提高呈上升的趋势,但各组相比差异不显著(P > 0.05)。方差分析结果显示,养殖密度的提高对刺参生长有一定的影响。其中,对WGR及SGR有极显著影响(P < 0.01)。随着养殖密度的增大,净产量、BWR均有所升高,但相比差异均不显著(P > 0.05)。F10组的FCR最小,为0.76±0.06,与F20组(1.26±0.34)相比差异不显著,但显著低于F30组(1.72±0.03) (P < 0.05)。
|
|
表 1 不同养殖密度刺参的生长情况 Tab.1 Growth of the sea cucumber A. japonicus under different culture densities |
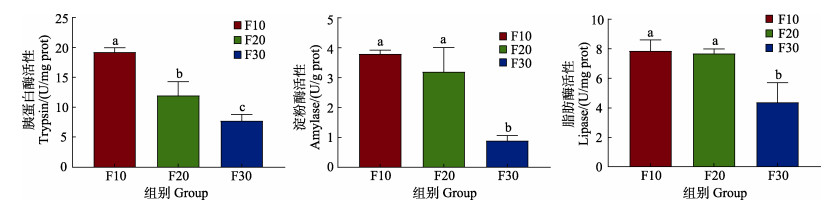
从图 2可以看出,养殖密度对胰蛋白酶、淀粉酶和脂肪酶活性均有一定的影响,随着养殖密度的提高,3种消化酶活性均呈下降的趋势。其中,F30组的胰蛋白酶活性显著低于F20组,F20组显著低于F10组(P < 0.05);F10组与F20组的淀粉酶和脂肪酶活性相比无显著差异(P > 0.05),均显著高于F30组(P < 0.05)。
|
图 2 养殖密度对刺参肠道消化酶活性的影响 Fig.2 Effect of culture density on the activities of digestive enzymes in the sea cucumber A. japonicus |
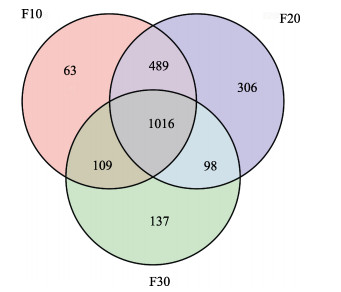
对刺参肠道样品进行16S高通量测序。结果显示,F10、F20、F30组特有OTU数目分别为63个、306个和137个,共有OTU数目为1 016个,其中,F20组特有微生物种类最多,与F10组共有OTU数最多(489个),F20组与F10组相似性较高(图 3)。根据测序所获得的OTU分类及其丰度信息,对各样本的Alpha多样性分析的结果见表 2。所测定样品ACE指数为943.06~1 707.26,Chao1指数为901.39~1 724.52,Simpson指数在0.96~0.99之间;Shannon指数在6.63~9.28之间。Alpha多样性指数最大值均出现在F20组,最小值均出现在F30组。对不同养殖密度下刺参肠道样品Alpha多样性指数进行差异显著性分析显示,F20组ACE指数、Chao1指数、Shannon指数和Simpson指数均为最高。F10组ACE指数显著低于F20组(P < 0.05),其他指数与F20组相比均无显著差异(P > 0.05)。F30组的ACE指数、Chao1指数、Shannon指数和Simpson指数均显著低于其他密度组(P < 0.05)。结果表明,F20组刺参肠道的微生物种类丰富且分布均匀度高于F10组与F30组,F30组刺参的微生物种类丰富度和多样性指数最低,且与其他密度组相比存在显著差异(P < 0.05)。
|
图 3 不同养殖密度下刺参肠道菌群共有OTU分析 Fig.3 OTU analysis among intestinal microbiota of sea cucumber A. japonicus at different culture densities |
|
|
表 2 不同养殖密度下刺参肠道菌群Alpha多样性分析 Tab.2 Alpha diversity analysis of intestinal microbiota in the sea cucumber A. japonicus at different culture densities |
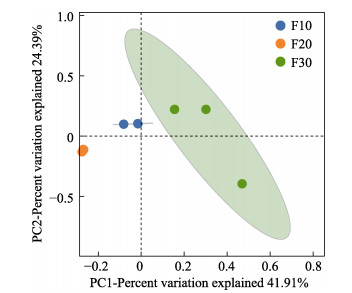
PCoA分析显示,各密度组间样品完全分离,差异较为明显。F10组和F20组内样品分布较为紧凑,菌群结构相似度高,F30组内样品较为分散,样品间菌群结构有一定差异(图 4)。
|
图 4 不同养殖密度刺参肠道菌群的PCoA分析 Fig.4 PCoA analysis of the intestinal microbiota in the sea cucumber A. japonicus at different culture densities |
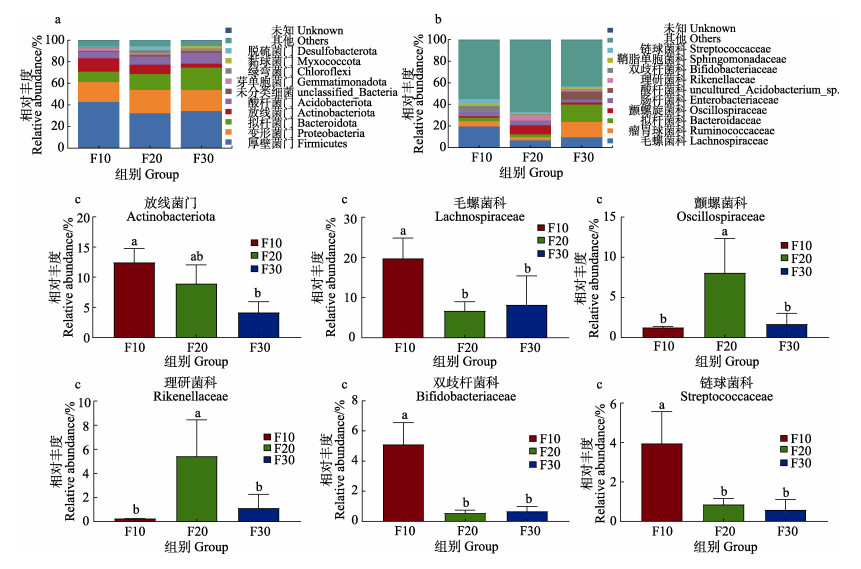
基于门水平,各密度组刺参肠道丰度前10的优势菌门见图 5a。从图 5a可以看出,肠道菌群主要以厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)以及酸杆菌门(Acidobacteriota) 等组成。F10、F20与F30组的群落组成基本一致,但优势菌群相对丰度稍有差异,前三优势菌门相对丰度总和分别为70.83%、68.65%和74.63%。随着密度的提高,厚壁菌门和放线菌门相对丰度呈下降的趋势,拟杆菌门和变形菌门则相反。F10组放线菌门相对丰度显著高于F30组(图 5c)(P < 0.05)。
|
图 5 不同养殖密度刺参肠道门、科水平菌群组成 Fig.5 Intestinal microbiota composition at phylum and family levels in the sea cucumber A. japonicus at different culture densities a:门水平相对丰度堆积;b:科水平相对丰度堆积;c:主要差异菌相对丰度 a: Relative abundance at phylum level; b: Relative abundance at family level; c: Relative abundance of the main different bacteria |
基于科水平,各密度组刺参肠道丰度前10的优势菌科见图 5b。从图 5b可以看出,各密度组肠道菌群主要由毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、拟杆菌科(Bacteroidaceae)、颤螺菌科(Oscillospiraceae)、肠杆菌科(Enterobacteriaceae)、理研菌科(Rikenellaceae)等组成。其中,毛螺菌科为F10组的第一优势菌科,相对丰度为19.56%;F20组第一优势菌科为瘤胃菌科,相对丰度为8.26%;F30组第一优势菌科拟杆菌科,相对丰度为16.12%。F10组、F20组和F30组的群落组成存在一定差异,优势菌科也不尽一致。随着养殖密度的提高,毛螺菌科、双歧杆菌科、链球菌科的相对丰度呈下降的趋势;F10组毛螺菌科、双歧杆菌科、链球菌科相对丰度显著高于F20组和F30组(图 5c)(P < 0.05);F20组颤螺菌科、理研菌科相对丰度显著高于F10组和F30组(图 5c)(P < 0.05)。
LEfSe分析结果显示,不同密度组肠道样品共有36个不同分类水平的细菌类群存在显著差异(图 6a)。其中,F10组肠道的显著性优势菌群主要是杆菌纲(Bacilli)、放线菌纲(Actinobacteria)、经黏液真杆菌属(Blautia)以及链球菌属(Streptococcus);F20组肠道的显著性优势菌群主要是瘤胃球菌科UCG_005属、Rikenellaceae_RC9_gut_group;F30组肠道的显著性优势菌群主要是Alkanindiges属(图 6b)。
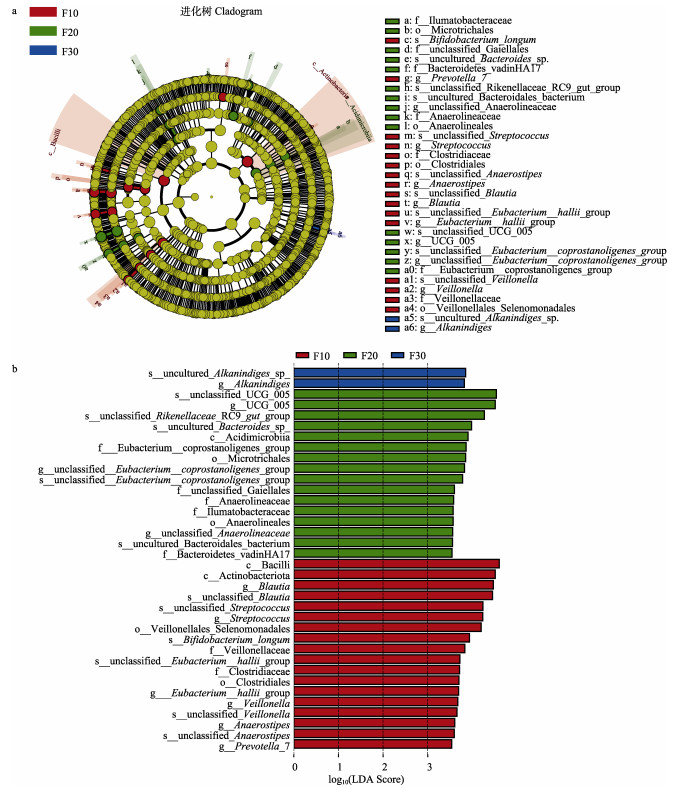
|
图 6 不同养殖密度刺参肠道菌群LEfSe分析环形树状图(a)和柱状图(b) Fig.6 LEfSe analysis ring dendrograms (a) and histogram (b) of intestinal microbiota in sea cucumber A. japonicus at different culture densities |
为进一步探究肠道差异菌与消化酶活性之间的关系,选择属水平上丰度>1%的菌进行了Pearson相关性分析。从图 7可以看出,共获得了3个与消化酶显著相关的肠道菌属,其中,链球菌属(Streptococcus)与Trypsin呈极显著正相关(P < 0.01);unclassified_ Muribaculaceae与胰蛋白酶活性和脂肪酶活性均呈显著正相关(P < 0.05);瘤胃球菌科的UCG_005与Lipase呈显著正相关(P < 0.05)。

|
图 7 肠道消化酶活性与差异菌属的皮尔森相关性分析 Fig.7 Pearson's correlation heatmap between digestive enzyme activities and different intestinal bacteria at genera level |
按照本实验周期,对一组网排(500口网箱)进行效益估算,除饲料、苗种投入成本外,其他成本基本一致,F10、F20、F30组产值分别为114.00、199.50和276.75万元,净收益分别为31.54、40.78和41.77万元;F20组与F30组净收益相差不大,F20组净收益是F10组1.29倍(表 3)。
|
|
表 3 不同养殖密度下养殖效益分析 Tab.3 Analysis of culture benefit at different culture density |
总体上看,近海养殖网箱有良好的水体交换条件,各密度组的温度、盐度、DO和pH等环境因子基本一致。此外,同一区域内网箱附着的天然饵料基本没有差别;根据前期实验确定的饲料投喂水平能满足养殖刺参的需求,因此,饵料应该不是一个限制性因素。本研究中,养殖刺参出现的生长、消化酶活性和肠道菌群的差异,可能主要与密度胁迫下的生理应激有关。
本研究发现,养殖密度的提高对刺参生长发育存在显著影响。实验结束时,刺参的WGR与SGR随着养殖密度的提高而显著降低;FCR随养殖密度的提高而显著升高。Xia等(2017)和马明星(2023)研究表明,养殖密度可能会从摄食、消化和空间竞争等方面影响养殖生物的生长情况。在高养殖密度压力下,养殖对象需要更多的能量消耗来获得食物以及协调种间关系(Jørgensen et al, 1993)。Dong等(2010)研究发现,刺参具有明显的社会等级行为,较小的刺参个体会受到较大个体的影响,表现出摄食率降低、呼吸排泄增加等明显的能量变化。Pei等(2014)研究发现,养殖密度的增加导致刺参SGR显著下降,推测与种内个体间物理接触交流和某种化学信息交流有关,降低了饲料转化效率和生长所需能量的比例。因此,本研究在高密度条件下,刺参个体间接触交流增加,个体需要更多摄食活动以获取食物,同时,劣势个体会受到优势个体的胁迫影响,导致摄食减弱,这些应激压力可能造成能量消耗增加以及部分刺参的摄食不足,导致FCR增大以及生长不良。此外,在较高养殖密度下,网衣底部受到浪涌影响会变形凹陷,刺参与饲料、粪便等聚集在凹陷处,粪便增多而不易排出,网箱底部微环境不良也可能导致了高密度组生长不佳。因此,要想进一步提高养殖密度,需要对网箱结构进行优化改进。
消化酶是评价刺参消化功能的重要指标之一,与其消化吸收密切相关,进而影响刺参的生长发育(何舟, 2014)。本研究中,低密度组刺参各项消化酶活性最高,高密度组消化酶活性最低,这与先前很多研究结果相一致。如范文浩等(2021)研究发现,克氏原螯虾(Procambarus clarkii)在适宜密度时消化酶活性最高;Liu等(2018)研究发现,罗非鱼的消化酶活性受养殖密度影响而发生了显著改变;Adineh等(2019)也研究了鲤鱼消化酶活性随着养殖密度的提高而显著降低。姚琦(2022)研究表明,养殖密度过大会影响水产动物的摄食量,从而影响消化酶活性。此外,高养殖密度下的应激胁迫会抑制机体能量代谢,可能会影响消化酶的合成与分泌(肖鸣鹤等, 2012; Wang et al, 2018; 张海恩等, 2021)。本研究中,刺参消化酶活性的降低可能与高密度胁迫下食物摄入不足和消化酶合成分泌下降有关,而消化能力受损导致了刺参生长缓慢。
刺参肠道中存在着复杂的菌群结构,肠道菌群与宿主的生长、健康状况及机体消化代谢息息相关(陈贞年等, 2021)。肠道菌群结构也受到生物体状态及养殖密度等因素的显著影响(Xiong et al, 2018; Wang et al, 2018; Parma et al, 2020)。本研究发现,随着养殖密度的提高,刺参肠道菌群Alpha多样性指数呈下降的趋势,说明过高的养殖密度可能会抑制刺参肠道微生物丰富度及多样性。这与虹鳟(Oncorhynchus mykiss)的研究结果相似(Brown et al, 2019),同样与在不同密度下凡纳对虾(Penaeus vannamei)的研究结果相一致(袁航等, 2023)。本研究中,各密度组养殖网箱较为一致的水质因子和环境微生物降低了环境因素对刺参肠道的影响,相似的饲料投入降低了营养因素对肠道菌群的影响,但肠道菌群还受到养殖生物体自身的调控(Nayak, 2010)。Wang等(2018)研究认为,不同养殖密度下,团头鲂肠道微生物之间的显著差异是生理调节的结果,这又会影响了鱼类的消化和肠道健康。因此,在高密度条件下,刺参自身摄食和消化生理的变化可能造成了刺参肠道微生物结构的改变。本研究中,刺参肠道优势菌门为厚壁菌门、变形菌门和拟杆菌门,这与已报道的福建吊笼养殖和池塘养殖刺参肠道优势菌门为变形菌门和拟杆菌门不一致(丁斯予等, 2019; 刘艳霞等, 2023),这种差异可能与环境条件和养殖方式不同有关,最有可能的是投喂含有益生菌的片状饲料对刺参肠道菌群造成的影响。郝爽等(2022)研究发现,投喂搭配了益生菌的饲料能促进厚壁菌门的增殖。
刺参肠道菌群随着养殖密度的升高在不同分类水平上均发生了一定改变。在门水平上,随着养殖密度的升高,高密度组中变形菌门呈升高的趋势,放线菌门呈显著减少的趋势,厚壁菌门与拟杆菌门的比值低于低密度组。Shin等(2015)研究表明,变形菌门中的许多物种被认为是水产动物的有害菌,也是增加患病风险的潜在标志;厚壁菌门与拟杆菌门比值的降低与动物体重减轻有直接关系(Ley et al, 2006);而放线菌门可不断产生对生物有益的活性物质(Keulen et al, 2014)。在科水平上,厚壁菌门的毛螺菌科以及放线菌门的双歧杆菌科在低密度组中显著提高;瘤胃球菌科作为各组的第2优势菌科,在低密度组中存在相对丰度略高于其他组;拟杆菌门的理研菌科在中密度组中显著提高。研究发现,瘤胃球菌科和毛螺菌科可以通过影响肠道pH来抑制病原微生物的生长(Nava et al, 2011; Zeng et al, 2019)。双歧杆菌作为一种重要的肠道有益微生物,对改善肠道菌群组成、提高抗病能力具有重要作用(孟霄鹏等, 2017)。此外,通过对LEfSe分析发现,F10组中差异菌群包括芽孢杆菌纲、放线菌纲以及链球菌属。芽孢杆菌可以适应多种环境,这在一定程度上使宿主能够具有适应多种不良环境的能力(刘玉升等, 2006)。芽孢杆菌和链球菌等益生菌是水产养殖中常用的益生菌(Tyagi et al, 2017)。放线菌能促进碳水化合物的消化吸收,分泌的抗菌素类物质能够起到益生菌的作用(冯慧军等, 2017)。F20组中差异菌群主要包括瘤胃球菌UCG_005与Rikenellaceae_RC9_gut_group。瘤胃球菌属作为肠道屏障的重要组成部分,参与哺乳动物肠道黏膜相关代谢,相对丰度的下降极有可能导致肠道菌群紊乱以及肠道屏障的破坏(Nava et al, 2011)。Rikenellaceae_ RC9_gut_group属于理研菌科,在消化中发挥着重要作用(Zhang et al, 2017),理研菌的减少被认为是炎症发生的一个指标(Breton et al, 2013; Schwab et al, 2014)。F30组中差异菌群主要是Alkanindiges属,Alkanindiges属的Nitrosomonas是养殖尾水生物脱氮过程的关键性功能细菌,其相对较高的丰度说明具有良好的硝化功能(陈小红等, 2023)。综上所述,随着刺参养殖密度的提高,菌群结构发生了明显改变,过高的养殖密度可能不利于肠道菌群健康,对刺参可能造成潜在危害。
肠道菌群种类及丰度与消化酶活性息息相关,一些益生菌能分泌多种消化酶,进而提高肠道的消化能力(刘淑兰等, 2017; 崔广鑫等, 2022)。本研究通过肠道菌群与消化酶活性相关分析结果显示,胰蛋白酶活性与Streptococcus和unclassified_Muribaculaceae呈现正相关,脂肪酶与unclassified_Muribaculaceae和UCG_005呈正相关。黄莉莉等(2022)研究显示,Muribaculaceae可有效发酵碳水化合物,并产生短链脂肪酸,而短链脂肪酸可为肠道细胞提供能量,并具有抗炎作用。Sibai等(2020)研究发现,Muribaculaceae可以通过其代谢产物来延长小鼠(Mus musculus)的寿命。瘤胃球菌属UCG_005是肠道中的主要纤维降解菌,高蛋白日粮仔猪肠道中瘤胃球菌属丰度显著降低(慕春龙, 2016)。关于这些肠道细菌与消化酶活性相关性的研究未见报道,它们的丰度变化可能与消化酶活性存在一定联系,推测这些菌属可能是潜在的消化酶促进菌,但具体作用机制有待研究。
从养殖效益方面分析,随着养殖密度的提高,产值和净收益均大幅提高,但F30组的效益与F20组接近,而投入成本较高,并从生长指标、消化酶活性及肠道菌群结构来看,密度过高对刺参健康状况可能存在一定的不利影响,综合分析认为,F20组在刺参生长、健康状况及产出效益等方面最好,现有小网箱在投喂模式下的养殖密度适宜提高到20 kg/箱。
4 结论本研究结果表明,养殖密度对浅海网箱养殖刺参生长、消化酶活性以及肠道菌群结构均有一定影响,在片状饲料投喂条件下,增大养殖密度可提高网箱养殖刺参的净产量,进而增加养殖效益,但养殖密度过大对刺参生长、消化能力和肠道菌群结构有一定的不利影响。因此,在养殖生产中需要合理控制投苗密度,现有小网箱在投喂模式下的养殖密度宜提高到20 kg/箱,以实现网箱的高效利用,提高养殖效益。
ADINEH H, NADERI M, KHADEMI HAMIDI M, et al. Biofloc technology improves growth, innate immune responses, oxidative status, and resistance to acute stress in common carp (Cyprinus carpio) under high stocking density. Fish & Shellfish Immunology, 2019, 95: 440-448 |
BRETON J, MASSART S, VANDAMME P, et al. Ecotoxicology inside the gut: impact of heavy metals on the mouse microbiome. BMC Pharmacology and Toxicology, 2013, 14(1): 62 DOI:10.1186/2050-6511-14-62 |
BROWN R M, WIENS G D, SALINAS I. Analysis of the gut and gill microbiome of resistant and susceptible lines of rainbow trout (Oncorhynchus mykiss). Fish & Shellfish Immunology, 2019, 86: 497-506 |
Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2023. Beijing: China Agriculture Press, 2023 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴. 北京: 中国农业出版社, 2023]
|
CHEN M Q, ZHANG L, YANG X M, et al. Experimental rearing of sandfish Holothuria scabra juveniles in net cages on open sea. Fisheries Science, 2015, 34(9): 571-574 [陈明强, 张立, 杨学明, 等. 海上网箱培育大规格糙海参苗试验. 水产科学, 2015, 34(9): 571-574] |
CHEN X H, ZENG H D, QIU D G, et al. Analysis of bacterial community structure in biofilters with different fillers using high-throughput sequencing. Marine Environmental Science, 2023, 42(4): 550-557 [陈小红, 郑惠东, 仇登高, 等. 基于高通量测序的不同填料生物滤池细菌群落结构分析. 海洋环境科学, 2023, 42(4): 550-557] |
CHEN Z N, WANG X Q, LUO L T, et al. High-throughput sequencing analysis of the effects of sanguinarine on Trionyx sinensis intestinal microbiota. Progress in Fishery Sciences, 2021, 42(1): 177-185 [陈贞年, 王晓清, 罗来婷, 等. 高通量测序分析血根碱对中华鳖肠道菌群结构的影响. 渔业科学进展, 2021, 42(1): 177-185] |
COSTA F P D, GOMES B S F D F, PEREIRA S D D N A, et al. Influence of stocking density on the behaviour of juvenile Litopenaeus vannamei (Boone, 1931). Aquaculture Research, 2016, 47(3): 912-924 DOI:10.1111/are.12550 |
CUI G X, SUN N, WANG T T, et al. Effects of Bacillus cereus YB1 on growth performance, intestinal digestive enzymes, liver antioxidant enzymes, and intestinal tissue structure of juvenile turbot (Scophthalmus maximus). Progress in Fishery Sciences, 2022, 43(1): 97-105 [崔广鑫, 孙娜, 王腾腾, 等. 蜡样芽孢杆菌YB1对大菱鲆幼鱼生长性能、肠道消化酶、肝脏抗氧化酶及肠道组织结构的影响. 渔业科学进展, 2022, 43(1): 97-105] |
DING S Y, WANG L, XU H C, et al. Bacterial community structure and function in the intestinal tracts and culture environment of sea cucumber (Apostichopus japonicus). Chinese Journal of Ecology, 2019, 38(1): 210-220 [丁斯予, 王荦, 徐瀚晨, 等. 刺参肠道及养殖环境菌群结构与功能. 生态学杂志, 2019, 38(1): 210-220] |
DONG S L, LIANG M, GAO Q F, et al. Intra-specific effects of sea cucumber (Apostichopus japonicus) with reference to stocking density and body size. Aquaculture Research, 2010, 41(8): 1170-1178 |
DU F K, LI Y, TANG Y K, et al. Response of the gut microbiome of Megalobrama amblycephala to crowding stress. Aquaculture, 2019, 500: 586-596 DOI:10.1016/j.aquaculture.2018.10.067 |
EBRAHIMI, M H, IMANPOUR, M R, ADLOU, M N. Effects of stocking density on growth factors, survival and blood and tissue parameters, in giant gourami (Osphronemus goramy) (Lacepede, 1801). Journal of Fisheries, 2010, 4(214): 97-105 |
EL-KHALDI A T F. Effect of different stress factors on some physiological parameters of Nile tilapia (Oreochromis niloticus). Saudi Journal of Biological Sciences, 2010, 17(3): 241-246 DOI:10.1016/j.sjbs.2010.04.009 |
FAN W H, FANG L, ZHOU J, et al. Effects of stocking density on growth, digestive enzyme and immune enzyme activities of red swamp crayfish Procamabarus clarkii. Fisheries Science, 2021, 40(2): 261-266 [范文浩, 方刘, 周锦, 等. 养殖密度对克氏原螯虾生长及消化酶、免疫酶活性的影响. 水产科学, 2021, 40(2): 261-266] |
FENG H J, ZHAI L, CHENG K, et al. The research advance of genus Thermoactinomyces. Food and Fermentation Industries, 2017, 43(11): 257-261 [冯慧军, 翟磊, 程坤, 等. 高温放线菌属研究进展. 食品与发酵工业, 2017, 43(11): 257-261] |
HAO S, ZHANG Z G, YOU H Z, et al. Effects of compound probiotics on intestinal microflora of Pacific white shrimp Litopenaeus vannamei. Fisheries Science, 2022, 41(4): 597-604 [郝爽, 张振国, 尤宏争, 等. 复合益生菌对凡纳滨对虾肠道菌群结构的影响. 水产科学, 2022, 41(4): 597-604] |
HE Z. Studies on the effects of different diets on the growth, body composition, non-specific immunity and digestive enzymes activities of sea cucumber Apostichopus japonicus. Master´s Thesis of Dalian Ocean University, 2014 [何舟. 不同饲料对刺参生长、体成分、免疫相关酶和消化酶活性的影响. 大连海洋大学硕士研究生学位论文, 2014]
|
HUANG L L, ZHENG T, TANG Y, et al. Effects of Dendrobium officinale polysaccharides on lumen-associated microbiota in high fat diet-fed mice. Journal of Food Safety and Quality, 2022, 13(4): 1082-1088 [黄莉莉, 郑淘, 唐圆, 等. 铁皮石斛多糖对高脂饮食小鼠肠腔菌群的影响. 食品安全质量检测学报, 2022, 13(4): 1082-1088] |
JØRGENSEN E H, CHRISTIANSEN J S, JOBLING M. Effects of stocking density on food intake, growth performance and oxygen consumption in Arctic charr (Salvelinus alpinus). Aquaculture, 1993, 110(2): 191-204 DOI:10.1016/0044-8486(93)90272-Z |
KEULEN G V, DYSON P J. Production of specialized metabolites by Streptomyces coelicolor A3(2). Advances in Applied Microbiology, 2014, 89: 217-266 |
LEY R E, TURNBAUGH P J, KLEIN S, et al. Microbial ecology: Human gut microbes associated with obesity. Nature, 2006, 444(7122): 1022-1023 DOI:10.1038/4441022a |
LI C H. Research progress on molecular regulation mechanism of skin ulcer syndrome in sea cucumber Apostichopus japonicus: A review. Journal of Dalian Ocean University, 2021, 36(3): 355-373 [李成华. 刺参腐皮综合征发生的分子调控机制研究进展. 大连海洋大学学报, 2021, 36(3): 355-373] |
LIU G, YE Z Y, LIU D Z, et al. Influence of stocking density on growth, digestive enzyme activities, immune responses, antioxidant of Oreochromis niloticus fingerlings in biofloc systems. Fish & Shellfish Immunology, 2018, 81: 416-422 |
LIU S L, CHEN J, LI J, et al. Effects of complex- probiotic-preparation on the growth, digestive enzymes and the nonspecific immune indices of Atlantic salmon (Salmo salar). Progress in Fishery Sciences, 2017, 38(5): 100-106 [刘淑兰, 陈娟, 李杰, 等. 复合益生菌制剂对大西洋鲑(Salmo salar)生长、消化酶和非特异性免疫指标的影响. 渔业科学进展, 2017, 38(5): 100-106] |
LIU Y S, CHEN Y X, LV F, et al. Study on the primary identification of intestinal bacteria in Lycoima delicatula (white). Journal of Shandong Agricultural University (Natural Science), 2006, 37(4): 495-498 [刘玉升, 陈艳霞, 吕飞, 等. 斑衣蜡蝉成虫肠道细菌的鉴定研究. 山东农业大学学报(自然科学版), 2006, 37(4): 495-498] |
LIU Y X, ZHANG J J, ZHOU Y Q, et al. Characteristics and correlation analysis of bacterial community structure in the gut of Apostichopus japonicus and culture water in suspension cages from north China. Progress in Fishery Sciences, 2023, 44(6): 190-202 [刘艳霞, 张靖婧, 周叶青, 等. 北方吊笼养殖刺参肠道及其养殖环境菌群结构特征及其相关性分析. 渔业科学进展, 2023, 44(6): 190-202] |
MA M X. Study on the diversity of the intestinal flora of Sebastodes schlegeli under different culture densities and patterns. Master´s Thesis of Dalian Ocean University, 2023 [马明星. 不同养殖密度与模式下许氏平鲉肠道菌群多样性研究. 大连海洋大学硕士研究生学位论文, 2023]
|
MAHMOUD H K, REDA F M, ALAGAWANY M, et al. Ameliorating deleterious effects of high stocking density on Oreochromis niloticus using natural and biological feed additives. Aquaculture, 2021, 531: 735900 DOI:10.1016/j.aquaculture.2020.735900 |
MENG X P, MENG Y, WANG Y, et al. Effects of probiotics on immunologic functions and intestinal microflora in Pacific white leg shrimp Litopenaeus vannamei. Fisheries Science, 2017, 36(1): 60-65 [孟霄鹏, 孟阳, 王悦, 等. 益生菌对凡纳滨对虾免疫功能及肠道菌群的影响. 水产科学, 2017, 36(1): 60-65] |
MU C L. Effects of dietary protein content on host metabolism and gut microbiota in rats and piglets. Doctoral Dissertation of Nanjing Agricultural University, 2016 [慕春龙. 日粮蛋白质水平对大鼠和仔猪机体代谢和肠道微生物的影响. 南京农业大学博士研究生学位论文, 2016]
|
NAVA G M, STAPPENBECK T S. Diversity of the autochthonous colonic microbiota. Gut Microbes, 2011, 2(2): 99-104 DOI:10.4161/gmic.2.2.15416 |
NAYAK S K. Role of gastrointestinal microbiota in fish. Aquaculture Research, 2010, 41(11): 1553-1573 DOI:10.1111/j.1365-2109.2010.02546.x |
PARMA L, PELUSIO N F, GISBERT E, et al. Effects of rearing density on growth, digestive conditions, welfare indicators and gut bacterial community of gilthead sea bream (Sparus aurata, L. 1758) fed different fishmeal and fish oil dietary levels. Aquaculture, 2020, 518: 734854 |
PEI S R, DONG S L, WANG F, et al. Effects of stocking density and body physical contact on growth of sea cucumber, Apostichopus japonicus. Aquaculture Research, 2014, 45(4): 629-636 DOI:10.1111/are.12004 |
SCHWAB C, BERRY D, RAUCH I, et al. Longitudinal study of murine microbiota activity and interactions with the host during acute inflammation and recovery. The International Society for Microbial Ecology Journal, 2014, 8(5): 1101-1114 |
SHENG W B. Study on the optimal binder for the feeds of sea cucumber Apostichopus japonicus under different culture patterns. Master´s Thesis of Dalian Ocean University, 2022 [盛伟博. 不同养殖模式下刺参饲料中适宜粘合剂的研究. 大连海洋大学硕士研究生学位论文, 2022]
|
SHIN N R, WHON T W, BAE J W. Proteobacteria: Microbial signature of dysbiosis in gut microbiota. Trends in Biotechnology, 2015, 33(9): 496-503 |
SIBAI M, ALTUNTA E, YLDRM B, et al. Microbiome and longevity: High abundance of longevity-linked Muribaculaceae in the gut of the long-living rodent Spalax leucodon. Omics: A Journal of Integrative Biology, 2020, 24(10): 592-601 |
TYAGI A, SINGH B. Microbial diversity in rohu fish gut and inland saline aquaculture sediment and variations associated with next-generation sequencing of 16s rRNA gene. Journal of Fisheries and Life Sciences, 2017, 2(1): 1-8 |
WANG J Q, DONG E D, ZHANG Y M, et al. Effects of stocking density on growth and survival of sea cucumber (Apostichopus japonicus) in a net cage positioned in an earthern pond. Fisheries Science, 2011, 30(10): 621-625 [王吉桥, 董恩东, 张玉满, 等. 土池网箱育苗中放养密度对刺参生长及成活的影响. 水产科学, 2011, 30(10): 621-625] |
WANG Y W, ZHU J, GE X P, et al. Effects of stocking density on the growth performance, digestive enzyme activities, antioxidant resistance, and intestinal microflora of blunt snout bream (Megalobrama amblycephala) juveniles. Aquaculture Research, 2018, 50(1): 236-246 |
WU Y Q, ZHANG Y X, DU R B, et al. Effects of different size and density on intermediate seedling culture of sea cucumber, Apostichopus japonicus in net cages disposed in earthen ponds. Fisheries Science, 2016, 35(6): 633-638 [吴艳庆, 张玉祥, 杜荣斌, 等. 不同规格和投苗密度对仿刺参池塘网箱保苗效果的影响. 水产科学, 2016, 35(6): 633-638] |
XIA B, REN Y C, WANG J Y, et al. Effects of feeding frequency and density on growth, energy budget and physiological performance of sea cucumber Apostichopus japonicus (Selenka). Aquaculture, 2017, 466: 26-32 |
XIAO M H, XIAO Y P, WU Z Q, et al. Effects of stocking density on growth, digestive enzyme activities and biochemical indices of juvenile Procambarus clarkii. Journal of Fisheries of China, 2012, 36(7): 1088-1093 [肖鸣鹤, 肖英平, 吴志强, 等. 养殖密度对克氏原螯虾幼虾生长、消化酶活力和生理生化指标的影响. 水产学报, 2012, 36(7): 1088-1093] |
XIONG J B, DAI W F, QIU Q F, et al. Response of host-bacterial colonization in shrimp to developmental stage, environment and disease. Molecular Ecology, 2018, 27(18): 3686-3699 |
YANG H S, SUN J C, RU X S, et al. Current advances and technological prospects of the sea cucumber seed industry in China. Marine Sciences, 2020, 44(7): 2-9 [杨红生, 孙景春, 茹小尚, 等. 我国刺参种业态势分析与技术创新展望. 海洋科学, 2020, 44(7): 2-9] |
YAO Q. Effects of different stocking densities on the growth, digestibility, and antioxidant capacity of the red claw crayfish, Cherax quadricarinatus, under rice-shrimp symbiosis mode. Master´s Thesis of Jilin Agricultural University, 2022 [姚琦. 稻虾共生模式下不同放养密度对红螯螯虾生长、消化及抗氧化能力的影响. 吉林农业大学硕士研究生学位论文, 2022]
|
YUAN H, HU N J, CHEN J, et al. Effects of stocking density on the growth performance, intestinal digestive enzyme activities and micro flora structure of Litopenaeus vannamei. Journal of Southern Agriculture, 2023, 54(1): 289-302 [袁航, 胡乃捷, 陈俭, 等. 养殖密度对凡纳滨对虾生长性能及其肠道消化酶和菌群结构的影响. 南方农业学报, 2023, 54(1): 289-302] |
YUAN Q, QIAN J, REN Y, et al. Effects of stocking density and water temperature on survival and growth of the juvenile Chinese mitten crab, Eriocheir sinensis, reared under laboratory conditions. Aquaculture, 2018, 495: 631-636 |
ZENG X L, GAO X X, PENG Y, et al. Higher risk of stroke is correlated with increased opportunistic pathogen load and reduced levels of butyrate-producing bacteria in the gut. Frontiers in Cellular and Infection Microbiology, 2019, 9: 4 |
ZHANG H E, HE Y Y, LI J, et al. Effects of different stocking densities on the growth and energy metabolism of Fenneropenaeus chinensis. Progress in Fishery Sciences, 2021, 42(5): 70-76 [张海恩, 何玉英, 李健, 等. 不同养殖密度对中国明对虾生长和能量代谢的影响. 渔业科学进展, 2021, 42(5): 70-76] |
ZHANG J, SHI H T, WANG Y J, et al. Effect of dietary forage to concentrate ratios on dynamic profile changes and interactions of ruminal microbiota and metabolites in holstein heifers. Frontiers in Microbiology, 2017, 8: 2206 |



