2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学海洋科学学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306
渔业资源是人类食物的重要来源之一。但是,随着捕捞强度加大,全球已有超过30%的渔业资源遭受过度捕捞,约60%处于完全开发阶段(FAO, 2016)。为了适应捕捞压力、维持种群繁衍,渔业生物会在短时间内发生适应性进化,这个过程称为捕捞诱导进化(Fishing-induced evolution, FIE) (Jørgensen et al, 2007)。Rutter (1902)首次提出捕捞可能使鱼类退化,但由于不符合当时物种进化缓慢的观念,且缺乏相关理论支撑,同一时期很多类似研究都未受到重视,如Cooper等(1953)、Handford等(1977)和Borisov (1978)。20世纪末,研究发现过度捕捞导致大西洋鳕(Gadus morhua)生物量严重下降、性成熟年龄提前和体长变小(Olsen et al, 2004; Hutchings, 2004),恢复过程也变得十分缓慢(Sinclair et al, 2002),人们开始认识到捕捞可能诱导海洋生物发生快速进化并阻碍种群恢复(Kuparinen et al, 2007)。21世纪初,FIE逐渐成为渔业资源研究的热点问题之一。我国关注到FIE问题是在20世纪60年代,研究人员从“四大家鱼”中观察到“鱼类小型化”现象(朱成德等, 1979)。此后,在海洋捕捞和人工繁殖过程中,渔业生物也被发现存在小型化和性早熟现象(詹秉义等, 1986; 陈景元, 1985)。截止目前,FIE已经是一个普遍的生态学现象,影响着渔业生物的生物学、生理、行为和遗传结构等(付辉云等, 2015; Uusi-Heikkilä et al, 2008; Kokkonen et al, 2015),进而对渔获物质量、产量以及整个生态系统产生重要影响(Jørgensen et al, 2013; Kuparinen et al, 2016)。
为了掌握捕捞对渔业生物进化的作用机制,制定合理的渔业资源管理策略,需要对FIE进行深入研究。近年来,FIE的研究有很多,主要以鱼类作为研究对象,研究内容集中在捕捞对鱼类生活史特征和遗传结构的影响(Walraven et al, 2010; Diaz et al, 2015; Cuveliers et al, 2011)、探索多种研究方法在捕捞进化效应的应用(Pauli et al, 2014; 李莉等, 2016; Laugen et al, 2014)、FIE在种群和生态系统水平上的影响及其对渔业经济和管理的意义(Enberg et al, 2009; Eikeset et al, 2013)等。然而,由于受到气候变化、污染和围填海等多种因素影响(樊伟等, 2001),研究FIE的具体过程与机制难度较大,多数研究结论只是理论或实验预测,还缺少确切的野外观测证据(Heino et al, 2015; Hard et al, 2008)。我国尚未进行FIE的系统研究,少量相关研究主要探究鱼类生物学特征、种群结构变动及其管理对策(李忠义等, 2017; 朱晓光等, 2009),以及网具选择性、捕捞和环境变化对鱼类生物学特征和种群结构的影响(林群等, 2016; 孙鹏, 2013)等。本文综述了国内外FIE的相关研究结果,总结了FIE的主要研究方法和主要的捕捞方式(底拖网)在鱼类生长、性成熟和行为方面的影响,分析了其对种群恢复及渔业资源管理的意义,旨在为FIE的进一步研究和渔业资源管理提供参考资料。
1 研究方法研究FIE的难点之一在于如何厘清环境和捕捞压力、区分表型可塑性和进化作用,至今还没有一个十分有效的方法。20世纪末以前,主要利用简单的回归统计方法分析野外调查数据,但不能有效排除环境作用(Bigler et al, 1996)。之后的研究方法可大致分为4种,分别应用于不同方面的FIE研究,并各有其优缺点(Conover et al, 2009a) (表 1)。
|
|
表 1 捕捞诱导进化(FIE)的研究方法及其优缺点 Tab.1 Research methods of fishing-induced evolution (FIE) and their advantages and shortages |
一是野外生态学的方法,利用野外调查数据构建统计模型,用于排除环境影响。其中,使用最多的是概率成熟反应范式(Probabilistic maturation reaction norms, PMRN),该模型假设环境变化通过生长作用于性成熟,即未成熟鱼类在发育到性成熟的生长过程中已包含了影响性成熟的所有因素,其性成熟概率变化反映的是鱼类自身的变化——遗传进化。因此,PMRN方法可以在缺少遗传数据的情况下揭示鱼类的进化可能性,而且所需的年龄、体长和性成熟数据较容易获取、使用方法简单(Dieckmann et al, 2007)。但是,由于鱼类性成熟所受的部分外界影响因素可能并不影响其生长,因此,并未包含在此性成熟概率中,概率变化未能完全证实适应性进化的存在(Kraak, 2007)。
二是实验生态学方法,已广泛且有效地应用于各个研究领域。在FIE研究上也不例外,其应用范围包括探究捕捞对鱼类行为的影响(Sutter et al, 2012)、量化生物学特征的演化速率(Audzijonyte et al, 2013)、观测特征之间的共同演变(Cooke et al, 2007)和结合分子技术探究捕捞选择的遗传机制(Wijk et al, 2013; Uusi-Heikkilä et al, 2017)等。在人为控制的不同捕捞压力条件下,Conover等(2002)首次为海洋鱼类的FIE提供了实验证据。
三是数值模拟,得益于数据分析技术的发展,使用计算机模拟鱼类生活史动态有利于从中得出FIE的作用规律。如今,数值模拟方法多用于探究网具选择性的影响程度(Jørgensen et al, 2009)、过度开发时鱼类的恢复情况(Dunlop et al, 2009; Kuparine et al, 2012)以及量化FIE对渔业经济效益的影响(Zimmermann et al, 2015)等,但模拟结果与野外情况的一致性还需进一步验证。
四是遗传学方法,由于野外遗传数据缺乏,该方法一般结合实验生态学方法进行。根据已有的物种遗传信息,使用微卫星(Simple Sequence Repeats, SSR)和单核苷酸多态(Single nucleotide polymorphism, SNP)等基因标记,进行种内不同个体的比较,从而探究捕捞对鱼类遗传组成产生的影响(李莉等, 2016)。随着第二代测序技术的发展,采用基因组学的方法可以实现群体间大量位点的序列分析,识别出与选择作用相关的位点,并通过分析位点在个体内的功能,推测适应性进化机制,这将成为日后FIE研究的最有力的手段(Elmer et al, 2016; 柳莹等, 2016)。
2 捕捞诱导鱼类生物学特征进化使用具有选择性的捕捞网具以及在渔场、渔汛期定点定时作业都可能对渔业生物产生选择性,使生物种群向着适应选择压力的方向演变(Hsieh et al, 2010; Heino et al, 2015)。这里所说的选择性与渔业管理上的有所不同,后者以渔获的种类数区分,渔获种类多则选择性小,而这里所说是以生物的某一特征(体型、行为等)进行分类,如刺网较多选择体高且在一定体长范围内的个体,因此,刺网捕捞都具有高选择性,而且由于选择对象不同,其诱导进化方向和速率也有差异。捕捞诱导进化,一方面是因为捕捞大量移出体型较大的个体,同时也对基因型进行了定向选择(Liang et al, 2014); 另一方面捕捞使物种组成、栖息环境和种群密度等发生变化,从而通过改变营养关系、生活环境和生活习性间接影响鱼类生活史特征(Ricker, 1981),其特征进化主要表现在生长、性成熟和行为等方面(图 1) (Heino et al, 2015)。
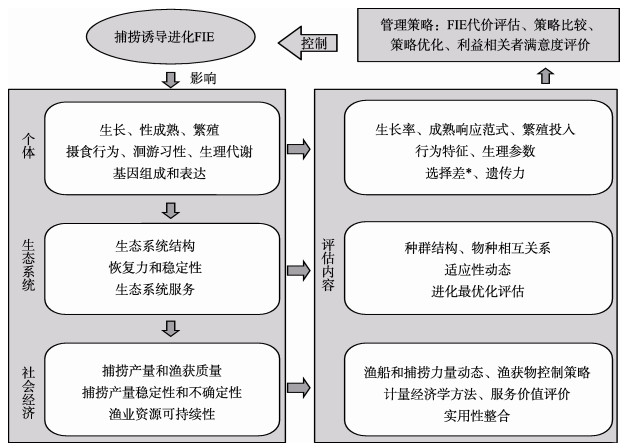
|
图 1 捕捞诱导进化(FIE)影响过程及进化影响评估(EvoIA)内容(Laugen et al, 2014) Fig.1 The fishing-induced evolution (FIE) impact process and its evolutionary impact assessment (EvoIA) (Laugen et al, 2014) *指被选择后剩余群体的特征平均值与选择前群体特征平均值的差值(朱伟俊等, 2007) * Refers to the average value difference of characteristics between surplus stock after being selected and stock before being selected (Zhu et al, 2007) |
大多数捕捞网具是对鱼类个体大小的直接选择,往往导致鱼类向个体变小的方向演变(Rutter, 1902)。多数水域都出现了鱼类小型化现象,如小个体渔获物的比例不断增加等(刘其根等, 2005)。有关捕捞影响鱼类生长的研究已有许多报道,但是,由于个体生长是鱼体内部生理条件和能量分配的体现,也受温度、饵料、栖息环境和捕食者等多种外部因素影响,研究难度较大,研究结果的差异也较大(Enberg et al, 2012)。
Ricker (1981)通过分析1951~1979年的渔业捕捞数据,发现5种太平洋鲑(Oncorhynchus spp.)在不同时期都存在不同程度的平均体长、体重下降现象,与温度、盐度之间没有显著的相关关系,指出捕捞是导致鱼类生长变化的最主要原因,这与之后的大部分研究结论一致(Enberg et al, 2012)。Conover等(2002)利用实验生态学的方法,发现捕捞90%大个体使银汉鱼(Menidia menidia)在4个世代内体重下降了0.8 g,生长率下降了0.1 mm/d。Conover等(2002)认为,鱼类为了适应捕捞压力,把更多能量投入到性成熟和繁殖,使其用于生长的能量减少,导致生长变慢。同时,捕捞总是选择生长快、体长大的个体,可能导致生长快的基因型减少,生长慢的基因更多地遗传给后代。但也有大量研究表明,大规模捕捞使鱼类生长率增加,如伊利湖鲈鱼(Perca flavescens) (Spangler et al, 1977)、北海鲽(Pleuronectes platessa) (Walraven et al, 2010)、小黄鱼(Larimichthys polyactis) (单秀娟等, 2011)等。根据已有研究,造成结果差异的可能原因:一是研究对象的生活史策略不同,鱼类用于繁殖和生长的能量分配有所差异,生长快、寿命短的鱼类更倾向于增加自身繁殖力来维持种群繁衍(Silva et al, 2013; Morbey et al, 2018); 二是研究方法不同,实验生态学方法模拟的捕捞强度往往过大,且未考虑物种相互作用、密度效应、生境变化等影响因素(Andersen et al, 2009),而在自然环境中捕捞使种群密度降低、相对饵料丰度增加可能掩盖鱼类生长减慢的现象(Edeline et al, 2007); 三是捕捞的选择性使鱼类生物学特征发生共同演变(Walsh et al, 2006),如某些鱼类摄食率下降、觅食行为减少等(Walsh et al, 2006)。由于影响鱼类生长的因素很多,且过程复杂,不能单从表型特征分析中得出结论,需从生理和分子层面上进一步研究。
如今,研究普遍认为,捕捞可能诱导鱼类发生适应性进化,而不是以往所认为的表型可塑性变化(Jørgensen et al, 1990)。Hauser等(2002)对新西兰笛鲷(Pagrus auratus)群体的研究发现,遭受捕捞后其SSRs的杂合度和等位基因频率不断下降,群体遗传多样性随生物量的减少而下降。van Wijk等(2013)对孔雀鱼(Poecilia reticulate)进行的捕捞生态学实验发现,持续3个世代捕捞75%大个体,雄性孔雀鱼的进化速率是自然种群的2~5倍,平均体长下降了6.5%,位于Y染色体上的体长调控基因发生显著变化。最近的研究发现,斑马鱼(Danio rerio)的多个基因对捕捞作出响应,与其胚胎代谢、昼夜节律、压力响应、免疫系统等过程有关(Uusi-Heikkilä et al, 2015)。同时,捕捞还通过影响胰岛素通路的能量代谢调控基因,影响鱼类寿命(Roff, 2007)。Uusi-Heikkilä等(2017)认为,在捕捞过程中的鱼类遗传响应方面,基因表达变化比基因序列变化更有说服力。研究表明,选择性捕捞大个体使鱼类种群的差异表达基因增加了20%,其平均等位基因频率变化普遍高于非差异表达基因,鱼类可能在RNA加工和代谢、蛋白质代谢、核糖体合成和氮化合物代谢等方面响应捕捞。但基因差异表达的具体机制尚未明确,捕捞诱导鱼类遗传进化的对应关系还不清楚。除此之外,有研究表明,在某些情况下,气候等环境变化对鱼类生长的影响超过捕捞因素(Perez-Rodriguez et al, 2013),甚至改变鱼类遗传结构(Edeline et al, 2007)。气候变化(Brander, 2007)、鱼类种间竞争(Gobin et al, 2015)和生境变化(杨吝, 2005)等多方面因素可能加快或减弱FIE,需要进行综合考虑。
2.2 性成熟鱼类性成熟的主要影响因素包括体长、温度和捕捞(陈新军, 2004)。在捕捞诱导的特征演变中,鱼类性成熟相关的研究最多,一方面是因为性成熟特征的改变对种群繁殖、恢复和渔业经济效益有重要意义(詹秉义, 1995; Conover et al, 2002); 另一方面,性成熟方面数据较多。众多研究都表明,鱼类为了适应捕捞压力而提前性成熟(Heino et al, 2015)。这种变化可以用生活史进化理论来解释,鱼类性成熟年龄和体长大小与其生命活动中的权衡和适合度有关(聂海燕等, 2007)。鱼类进化成性早熟个体能缩短生长时间,降低发育至性成熟的死亡风险,并且有更多的能量用于繁殖,增加繁殖力(Conover et al, 2002),从而提高适合度,但同时个体竞争力和后代存活率会相应降低(Swain, 2011)。对鱼类而言,在高强度的捕捞压力下增加繁殖投入获得的收益远大于增加生长获得的收益,因此,捕捞可能促使鱼类向初次性成熟年龄和体长变小的方向演变(Kokkonen et al, 2015; Heino et al, 2013)。但也有学者认为,捕捞引起的鱼类性成熟进化程度不明显或不存在进化,其研究对象大多为短生命周期种群,如沙丁鱼(Sardina pilchardus) (Silva et al, 2013)、鲱(Clupea harengus) (Engelhard et al, 2004),可能是由于短生命周期鱼类在自然环境中也经历着较高的死亡率并且性成熟较早,捕捞作用对其影响较小,可在短时间内恢复(Feiner et al, 2015)。
捕捞诱导的鱼类性成熟特征变化是否可遗传的问题仍存在争议,如何区分温度、饵料、物种相互作用等引起的表型可塑性变化和捕捞诱导的适应性进化还没有有效的方法(Perez-Rodriguez et al, 2013)。目前,使用PMRN方法进行了大量研究(Kuparinen et al, 2007),其中,大部分结果表明,鱼类性成熟体长和年龄的变化存在进化可能性(Haugen et al, 2001)。如Pardoe等(2009)使用PMRN方法分析了1964~1999年大西洋鳕的性成熟变化,发现其成熟体长和年龄的降低不完全依赖于密度效应、生长可塑性变化和环境因子(温度、饵料丰度等)。结合遗传学方法,研究表明,捕捞过程中大西洋鳕在某些位点表现出高度分化,与PMRN中点的变化趋势存在相关性,而且其等位基因频率变化不能完全解释为群体洄游过程中的杂交或基因流,更多的是捕捞作用(Therkildsen et al, 2013)。但也有部分研究表明,鱼类遗传结构变化与温度存在一定相关性,鱼类生物学特性进化可能同时受到捕捞和环境的影响,二者间的相对影响程度及相互作用还需要更多关注(Perez-Rodriguez et al, 2013)。
鱼类性成熟提前可能导致多种后果,如繁殖力变化(Walsh et al, 2006)、卵径变小、孵化率降低、幼体存活率下降等(Conover et al, 2002)。其中,鱼类的繁殖力变化主要表现为鱼类相对性腺重变化、产卵前后体重差值变化和亲体体重变化等。以能量密度作为繁殖输出指标,有研究发现,亲体在繁殖期间体重显著下降,蛋白质和脂肪比例存在雌雄差异,更多能量被用于繁殖(Walraven et al, 2010)。但还没有足够证据能说明繁殖力的变化是由捕捞造成的,相反这些变化更可能与温度变化有关(O'Malley et al, 2013)。虽然捕捞引起鱼类繁殖力的适应性进化还未得到证实,但由于鱼类繁殖直接影响种群补充量,如果管理不当可能导致种群灭绝(詹秉义, 1995),因此,需要对渔业资源进行针对性管理。
2.3 行为捕捞的选择性还体现在鱼类行为上,包括摄食、求偶、育幼和洄游等(Cooke et al, 2007; Quinn et al, 2007),这些行为的改变在一定程度上影响鱼类生长、繁殖和分布。目前,这方面还鲜有研究,主要原因是鱼类行为的观测难度较大、缺乏有效数据(Leclerc et al, 2017)。虽然已有较多技术用于追踪鱼类的洄游路线(Walsh et al, 2006; Handegard et al, 2005),如体外和体内标记、数据储存式标记、声呐和回声探测仪追踪等,但很少应用到FIE研究上。已有研究大多使用实验生态学方法进行,研究比较深入的是大口黑鲈(Micropterus salmoides)实验(Philipp et al, 2015)。由于捕捞往往选择较活跃、大胆和受影响程度高的鱼类个体(Diaz et al, 2015),经过多个世代的钓捕选择,大口黑鲈留存个体对网具的敏感性增强,并将其遗传给后代(Philipp et al, 2009)。此外,伴随着生长变化、食物需求降低、代谢减慢、对捕食者的警惕性降低等多种生理和行为特征变化(Redpath et al, 2009; Cooke et al, 2007)。斑马鱼的生态学实验表明,捕捞使控制血清素合成的调控基因发生变化,从而影响了褪黑色素合成量,最终影响鱼类的摄食能力和攻击性(Uusi-Heikkilä et al, 2015),这可能是捕捞影响鱼类行为的内在机制。由于鱼类的行为习惯与体长相关,并具有一定遗传能力,因此,捕捞也可能通过直接影响鱼类行为(如摄食、活跃度、栖息地选择等)作用于其生长和性成熟(Biro et al, 2008)。
3 研究意义 3.1 对种群恢复的影响持续高强度的捕捞会使鱼类生活史、生理、行为和遗传等特征发生变化,进一步改变种群动态(Dunlop et al, 2015),降低种群稳定性(Kuparinen et al, 2016),最终影响种群恢复。但是,早在20世纪末关于海洋鱼类灭绝风险评估,研究人员没有考虑鱼类生物学特征和遗传进化,导致当今渔业种群可能正面临着潜在的灭绝风险(Musick, 1999)。据Hutchings (2000)统计,11科38种鱼类中大多数种类在15年内生物量降低了45%~99%,而且在之后的15年内,其生物量几乎没有恢复。
FIE对种群恢复影响的研究较少,主要采用实验生态学和数值模拟方法,大部分研究结果表明,FIE对鱼类生物学特征的恢复起阻碍作用。Conover等(2009b)通过生态学实验发现,在相同的捕捞和恢复时间间隔内,银汉鱼幼鱼生长几乎完全恢复,成鱼体长只恢复了50%。这是首次使用实验生态学方法探究遭受捕捞后鱼类的恢复能力,但实验只简单考虑了幼鱼和成鱼的体长恢复情况,且实验中较少的产卵群体数量(约100尾)可能影响实验结果。Uusi-Heikkilä等(2017)研究发现,在捕捞过程中差异表达的基因,在恢复阶段仍差异表达,涉及蛋白质的转运和定位、胰岛素信号通路等过程,可能因此影响种群恢复。基于大西洋鳕生态和演变动态(个体生长繁殖、密度依赖效应和环境变化)模拟捕捞,Enberg等(2009)发现,种群生物量恢复时间随捕捞强度和作用时间的增加而增加,当捕捞时间少于100年、捕捞率低于50%时,才能在较短时间内恢复到初始水平。基于物种保护目的,且不考虑环境因素,Kuparinen等(2012)的模拟结果与Enberg等(2009)的基本一致,此外还发现,由于发生进化,大西洋鳕的成熟体长和年龄恢复十分缓慢,恢复水平也低于捕捞前。但是,在捕捞进化作用下,鱼类亲体与补充量的恢复可能加快,保证了种群繁衍。为进一步探究捕捞对种群恢复的影响程度,今后可考虑在模型中加入性别选择(Hutchings et al, 2010)、栖息地指数(杨吝, 2005)及基因交流(Pukk et al, 2013)等影响因素。
捕捞诱导鱼类生活史特征和行为等发生适应性进化,不仅增加种群恢复时间而且加大种群恢复的不确定性(Neubauer et al, 2013)。为了加快种群恢复,首先需要全面了解渔业资源动态(Heino et al, 2015),考虑采用声学探测技术监测种群动态、分子标记评估种群遗传变化以及在模型中考虑自然因素及遗传因素等(Langard et al, 2015; Marty et al, 2015),从而对渔业资源进行有效管理。
3.2 对渔业资源管理的意义FIE,一方面改变鱼类生物学特征和种群丰度,影响其经济价值和产量(Eikeset et al, 2013); 另一方面降低物种多样性和遗传多样性,影响生态系统稳定和健康(Pinsky et al, 2014)。虽然FIE的作用机制还不明确,但不可否认的是,FIE影响着海洋生态系统服务,特别是食物的可持续产出。值得注意的是,在捕捞实验中,捕捞目标为重复产卵群体中的大个体时,渔获量逐渐下降,而捕捞目标为小个体时,渔获量几乎不变(Edley et al, 1988)。而对单次产卵群体,捕捞大个体和小个体都会使渔业产量下降(Conover et al, 2002)。由于实验处理方法不同,捕捞是否会对不同鱼种的渔获量产生不同的影响,还需要涉及更多鱼种的研究。总结已有研究,FIE使渔业经济效益下降的原因主要有以下几点:(1)捕捞导致鱼类体长变小,在限定最小网目的政策下,能捕捞到的个体更少,而且鱼类平均体重普遍下降(Conover et al, 2002); (2)捕捞导致亲体数量大量减少(Walsh et al, 2006),补充能力下降。虽然有研究表明,鱼类把能量更多地投入到繁殖中(Rijnsdorp et al, 2005),如怀卵量增加,但性成熟提前,导致卵质量下降、孵化率和幼体存活率降低,使补充量远低于捕捞死亡(Conover et al, 2002); (3)捕捞使鱼类对网具的敏感性增强且具有遗传能力,使鱼类更难捕获(Philipp et al, 2015)。
为了减弱和避免FIE产生不良影响,需要把捕捞诱导的已知和未知的生物、非生物因素及其之间的相互作用纳入渔业管理的范畴,使渔业经济效益和生态效益都保持在可持续范围内,这样的管理称为基于生态系统水平的渔业管理(Ecosystem approach to fisheries, EAF) (Garcia, 2003)。应用这种管理办法,首先要对各种因素及其产生的效应进行定量。定量FIE影响效应的方法称为进化影响评估(Evolutionary impact assessment, EvoIA) (Laugen et al, 2014),评估内容包括捕捞对鱼类生物学特征的影响、种群进化动态、社会经济动态和管理策略评估(图 1)。由于实现种群、生态和经济效应的定量评估十分困难,已有研究不多。较早使用这种方法的是Mollet (2010),其研究发现,考虑种群的生态和遗传过程时,现行的捕捞参考点并不是真正可持续的,长期实施会导致渔业产量随时间不断下降。随后,结合生态遗传模型和经济模型提出了生物经济模型(Bioeconomic model),模型中增加了鱼类价格随渔获量和需求量波动的过程,研究发现,忽略进化效应会高估捕捞产量和效益,并得出错误的管理目标(Zimmermann et al, 2015)。但是,使用不同的模型和参数估算方法,可能产生不同甚至相反的结果(Pinsky et al, 2014),需要对模型进行更多的敏感性分析和验证。
结合鱼类生物学特性和生态效应制定渔业资源管理策略,建议:(1)改进渔具结构,使渔获物体长组成符合的大个体,这主要应用于休闲渔业、钓具、陷阱类渔具; (2)增加种群遗传和生态系统水平上的研究,合理规划捕捞水域和设置生物学参考点; (3)降低捕捞力量,建立保护区。制定渔业管理政策时,还需要注意两点,一是不同生活史策略的鱼类受FIE影响可能不同; 二是FIE也可能通过营养关系作用于没有遭受捕捞的鱼类(张波, 2018)。
4 FIE研究展望FIE是渔业生物应对过度捕捞所作出的适应性响应。由于其影响范围广、作用过程复杂,不能仅仅依靠单一技术手段和单一物种研究,需结合进化种群统计学和数量遗传学等方法,建议以功能群为单位,利用基因标记进行长期野外监测并尽早开展相关实验研究。目前,尽管FIE在鱼类生物学特征和渔业资源管理意义方面已经有较多研究,但如何准确预测FIE?其作用方式是改变渔业种类的生物学特征、种群丰度、行为特征还是遗传结构?捕捞效应与气候变化(如温度升高、极端天气)之间的相互作用对渔业生物进化的影响如何?渔业生物进化对其个体、种群、群落、生态系统等影响如何进行量化?又是如何进一步影响社会经济效益?这些问题尚需进一步探究。
Andersen KH, Brander K. Expected rate of fisheries-induced evolution is slow. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(28): 11657-11660 DOI:10.1073/pnas.0901690106 |
Audzijonyte A, Kuparinen A, Fulton EA. How fast is fisheries- induced evolution? Quantitative analysis of modelling and empirical studies. Evolutionary Applications, 2013, 6(4): 585-595 DOI:10.1111/eva.12044 |
Barrett RDH, Hoekstra HE. Molecular spandrels: Tests of adaptation at the genetic level. Nature Reviews Genetics, 2011, 12(11): 767-780 DOI:10.1038/nrg3015 |
Bigler BS, Welch DW, Helle JH. A review of size trends among North Pacific salmon (Oncorhynchus spp.). Canadian Journal of Fisheries and Aquatic Sciences, 1996, 53(2): 455-465 DOI:10.1139/f95-181 |
Biro PA, Post JR. Rapid depletion of genotypes with fast growth and bold personality traits from harvested fish populations. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(8): 2919-2922 DOI:10.1073/pnas.0708159105 |
Borisov VM. The selective effect of fishing on the population structure of species with long life cycle. 1978, 18
|
Brander KM. The role of growth changes in the decline and recovery of North Atlantic cod stocks since 1970. ICES Journal of Marine Science, 2007, 64(2): 211-217 DOI:10.1093/icesjms/fsl021 |
Chebib J, Renaut S, Bernatchez L, et al. Genetic structure and within-generation genome scan analysis of fisheries-induced evolution in a lake whitefish (Coregonus clupeaformis) population. Conservation Genetics, 2016, 17(2): 473-483 DOI:10.1007/s10592-015-0797-y |
Chen JY. Discussion on the degeneration of fish characters in artificial propagation. China Fisheries, 1985(5): 6-7 [陈景元. 关于人工繁殖鱼类的性状退化问题探讨. 中国水产, 1985(5): 6-7] |
Chen XJ. Fisheries resource and fishing ground. Beijing: China Ocean Press, 2004 [陈新军. 渔业资源与渔场学. 北京: 海洋出版社, 2004]
|
Conover DO, Baumann H. The role of experiments in understanding fishery-induced evolution. Evolutionary Applications, 2009a, 2(3): 276-290 DOI:10.1111/j.1752-4571.2009.00079.x |
Conover DO, Munch SB, Arnott SA. Reversal of evolutionary downsizing caused by selective harvest of large fish. Proceedings Biological Sciences, 2009b, 276(1664): 2015-2020 DOI:10.1098/rspb.2009.0003 |
Conover DO, Munch SB. Sustaining fisheries yields over evolutionary time scales. Science, 2002, 297(5578): 94-96 DOI:10.1126/science.1074085 |
Cooke SJ, Suski CD, Ostrand KG, et al. Physiological and behavioral consequences of long-term artificial selection for vulnerability to recreational angling in a teleost fish. Physiological and Biochemical Zoology, 2007, 80(5): 480 DOI:10.1086/520618 |
Cooper, Edwin L. Growth of brook trout (Salvelinus fontinalis) and brown trout (Salmo trutta) in the Pigeon River. Michigan Academy of Science, 1953, 38: 151-161 |
Cuveliers EL, Volckaert FA, Rijnsdorp AD, et al. Temporal genetic stability and high effective population size despite fisheries-induced life-history trait evolution in the North Sea sole. Molecular Ecology, 2011, 20(17): 3555-3568 |
Dercole F, Rossa FD. A deterministic eco-genetic model for the short-term evolution of exploited fish stocks. Ecological Modelling, 2017, 343: 80-100 DOI:10.1016/j.ecolmodel.2016.10.016 |
Diaz PB, Wiech M, Heino M, et al. Opposite selection on behavioural types by active and passive fishing gears in a simulated guppy Poecilia reticulata fishery. Journal of Fish Biology, 2015, 86(3): 1030-1045 DOI:10.1111/jfb.12620 |
Dieckmann U, Heino M. Probabilistic maturation reaction norms: Their history, strengths, and limitations. Marine Ecology Progress, 2007, 335(4): 253-269 |
Dunlop ES, Eikeset AM, Stenseth NC. From genes to populations: How fisheries-induced evolution alters stock productivity?. Ecological Applications, 2015, 25(7): 1860-1868 DOI:10.1890/14-1862.1 |
Dunlop ES, Heino M, Dieckmann U. Eco-genetic modeling of contemporary life-history evolution. Ecological Applications: A Publication of the Ecological Society of America, 2009, 19(7): 1815-1834 DOI:10.1890/08-1404.1 |
Edeline E, Carlson SM, Stige LC, et al. Trait changes in a harvested population are driven by a dynamic tug-of-war between natural and harvest selection. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(40): 15799-15804 DOI:10.1073/pnas.0705908104 |
Edley MT, Law R. Evolution of life histories and yields in experimental populations of Daphnia magna. Biological Journal of the Linnean Society, 1988, 34(4): 309-326 DOI:10.1111/j.1095-8312.1988.tb01966.x |
Eikeset AM, Richter A, Dunlop ES, et al. Economic repercussions of fisheries-induced evolution. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(30): 12259-12264 DOI:10.1073/pnas.1212593110 |
Elmer KR. Genomic tools for new insights to variation, adaptation, and evolution in the salmonid fishes: A perspective for charr. Hydrobiologia, 2016, 783(1): 191-208 DOI:10.1007/s10750-015-2614-5 |
Enberg K, Jørgensen C, Dunlop ES, et al. Fishing-induced evolution of growth: Concepts, mechanisms and the empirical evidence. Marine Ecology, 2012, 33(1): 1-25 DOI:10.1111/j.1439-0485.2011.00460.x |
Enberg K, Jørgensen C, Dunlop ES, et al. Implications of fisheries-induced evolution for stock rebuilding and recovery. Evolutionary Applications, 2009, 2(3): 394-414 DOI:10.1111/j.1752-4571.2009.00077.x |
Engelhard GH, Heino M. Maturity changes in Norwegian spring-spawning herring Clupea harengus: Compensatory or evolutionary responses?. Marine Ecology Progress, 2004, 272(3): 245-256 |
Fan W, Cheng YH, Shen XQ. Effects of global environment change and human activity on fishery resources. Journal of Fishery Sciences of China, 2001, 8(4): 91-94 [樊伟, 程炎宏, 沈新强. 全球环境变化与人类活动对渔业资源的影响. 中国水产科学, 2001, 8(4): 91-94 DOI:10.3321/j.issn:1005-8737.2001.04.021] |
Feiner ZS, Chong SC, Knight CT, et al. Rapidly shifting maturation schedules following reduced commercial harvest in a freshwater fish. Evolutionary Applications, 2015, 8(7): 724-737 DOI:10.1111/eva.12285 |
Food and Agriculture Organization of the United Nations (FAO). The state of world fisheries and aquaculture 2016. Contributing to food security and nutrition for all. Rome: 2016, 1-45
|
Fu HY, Zhang YP, Fang CL, et al. Growth and structure analysis of Macrobrachium nipponensis exploited population in Poyang Lake. Jiangxi Fishery Science and Technology, 2015(3): 17-20 [付辉云, 张燕萍, 方春林, 等. 鄱阳湖日本沼虾捕捞种群生长与结构分析. 江西水产科技, 2015(3): 17-20 DOI:10.3969/j.issn.1006-3188.2015.03.006] |
Garcia SM. The ecosystem approach to fisheries: Issues, terminology, principles, institutional foundations, implementation and outlook. FAO Fisheries Technical Paper, 2003, 443: 71 |
Gobin J, Lester NP, Cottrill A, et al. Trends in growth and recruitment of Lake Huron lake whitefish during a period of ecosystem change, 1985 to 2012. Journal of Great Lakes Research, 2015, 41(2): 405-414 DOI:10.1016/j.jglr.2015.03.003 |
Handegard NO, Tjøstheim D. When fish meet a trawling vessel: Examining the behaviour of gadoids using a free-floating buoy and acoustic split-beam tracking. Canadian Journal of Fisheries and Aquatic Sciences, 2005, 62(10): 2409-2422 DOI:10.1139/f05-131 |
Handford P, Bell G, Reimchen T. A gillnet fishery considered as an experiment in artificial selection. Journal of the Fisheries Research Board of Canada, 1977, 34(7): 954-961 DOI:10.1139/f77-148 |
Hard JJ, Gross MR, Heino M, et al. Evolutionary consequences of fishing and their implications for salmon. Evolutionary Applications, 2008, 1(2): 388-408 DOI:10.1111/j.1752-4571.2008.00020.x |
Haugen TO, Vøllestad LA. A century of life-history evolution in grayling. Genetica, 2001, 112-113(1): 475-491 |
Hauser L, Adcock GJ, Smith PJ, et al. Loss of microsatellite diversity and low effective population size in an overexploited population of New Zealand snapper (Pagrus auratus). Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(18): 11742-11747 DOI:10.1073/pnas.172242899 |
Heino M, Baulier L, Boukal DS, et al. Can fisheries-induced evolution shift reference points for fisheries management?. ICES Journal of Marine Science, 2013, 70(4): 707-721 DOI:10.1093/icesjms/fst077 |
Heino M, Pauli BD, Dieckmann U. Fisheries-induced evolution. Annual Review of Ecology Evolution and Systematics, 2015, 46: 461-480 DOI:10.1146/annurev-ecolsys-112414-054339 |
Hsieh C, Yamauchi A, Nakazawa T, et al. Fishing effects on age and spatial structures undermine population stability of fishes. Aquatic Sciences, 2010, 72(2): 165-178 |
Hutchings JA, Sherrylynn R. Consequences of sexual selection for fisheries-induced evolution: An exploratory analysis. Evolutionary Applications, 2010, 1(4): 645-649 |
Hutchings JA. Collapse and recovery of marine fishes. Nature, 2000, 406(6798): 882-885 DOI:10.1038/35022565 |
Hutchings JA. Evolutionary biology: The cod that got away. Nature, 2004, 428(6986): 899-900 DOI:10.1038/428899a |
Jørgensen C, Enberg K, Dunlop ES, et al. Managing evolving fish stocks. Science, 2007, 318(5854): 1247-1248 DOI:10.1126/science.1148089 |
Jørgensen C, Ernande B, Fiksen Ø. Size-selective fishing gear and life history evolution in the Northeast Arctic cod. Evolutionary Applications, 2009, 2(3): 356-370 DOI:10.1111/j.1752-4571.2009.00075.x |
Jørgensen C, Holt RE. Natural mortality: Its ecology, how it shapes fish life histories, and why it may be increased by fishing. Journal of Sea Research, 2013, 75: 8-18 DOI:10.1016/j.seares.2012.04.003 |
Jørgensen T. Long-term changes in age at sexual maturity of Northeast Arctic cod (Gadus morhua L.). ICES Journal of Marine Science, 1990, 46(3): 235-248 DOI:10.1093/icesjms/46.3.235 |
Kokkonen E, Vainikka A, Heikinheimo O. Probabilistic maturation reaction norm trends reveal decreased size and age at maturation in an intensively harvested stock of pikeperch Sander lucioperca. Fisheries Research, 2015, 167: 1-12 DOI:10.1016/j.fishres.2015.01.009 |
Kraak SBM. Does the probabilistic maturation reaction norm approach disentangle phenotypic plasticity from genetic change?. Marine Ecology Progress, 2007, 335(2007): 295-300 |
Kuparinen A, Boit A, Valdovinos FS, et al. Fishing-induced life-history changes degrade and destabilize harvested ecosystems. Scientific reports, 2016, 6: 22245-22253 DOI:10.1038/srep22245 |
Kuparinen A, Hutchings JA. Consequences of fisheries-induced evolution for population productivity and recovery potential. Proceedings Biological Sciences, 2012, 279(1738): 2571-2579 DOI:10.1098/rspb.2012.0120 |
Kuparinen A, Merilä J. Detecting and managing fisheries-induced evolution. Trends in Ecology and Evolution, 2007, 22(12): 652-629 DOI:10.1016/j.tree.2007.08.011 |
Langard L, Skaret G, Jensen KH, et al. Tracking individual herring within a semi-enclosed coastal marine ecosystem: 3-dimensional dynamics from pre- to post-spawning. Marine Ecology Progress, 2015, 518: 267-279 DOI:10.3354/meps11065 |
Laugen AT, Engelhard GH, Whitlock R, et al. Evolutionary impact assessment: Accounting for evolutionary consequences of fishing in an ecosystem approach to fisheries management. Plant Systematics and Evolution, 2014, 15(1): 65-96 |
Leclerc M, Zedrosser A, Pelletier F. Harvesting as a potential selective pressure on behavioural traits. Journal of Applied Ecology, 2017, 54: 1941-1945 DOI:10.1111/1365-2664.12893 |
Li L, Zhang GF. The stress adaptation of the marine fishery organisms under the view of genome and its key scientific problems. Bulletin of Chinese Academy of Sciences, 2016, 31(12): 1347-1354 [李莉, 张国范. 基因组视域下海洋渔业生物对胁迫环境的适应策略研究. 中国科学院院刊, 2016, 31(12): 1347-1354] |
Li ZY, Wu Q, Shan XJ, et al. Interannual variations in fish community structure in the Bohai Sea. Journal of Fishery Sciences of China, 2017, 24(2): 403-413 [李忠义, 吴强, 单秀娟, 等. 渤海鱼类群落结构的年际变化. 中国水产科学, 2017, 24(2): 403-413] |
Liang ZL, Sun P, Yan W, et al. Significant effects of fishing gear selectivity on fish life history. Journal of Ocean University of China, 2014, 13(3): 467-471 DOI:10.1007/s11802-014-2167-7 |
Lin Q, Wang J, Yuan W, et al. Effects of fishing and environmental change on the ecosystem of the Bohai Sea. Journal of Fishery Sciences of China, 2016, 23(3): 619-629 [林群, 王俊, 袁伟, 等. 捕捞和环境变化对渤海生态系统的影响. 中国水产科学, 2016, 23(3): 619-629] |
Liu QG, Shen JZ, Chen MK, et al. Advances of the study on the miniaturization of natural economical fish resources. Journal of Shanghai Fisheries University, 2005, 14(1): 79-83 [刘其根, 沈建忠, 陈马康, 等. 天然经济鱼类小型化问题的研究进展. 上海海洋大学学报, 2005, 14(1): 79-83 DOI:10.3969/j.issn.1004-7271.2005.01.015] |
Liu Y, Gao L, Feng JR. Research progress on population genomics of marine fishes. Biotechnology Bulletin, 2016, 32(11): 30-37 [柳莹, 高丽, 冯俊荣. 海洋鱼类种群基因组学研究进展. 生物技术通报, 2016, 32(11): 30-37] |
Marty L, Dieckmann U, Ernande B. Fisheries-induced neutral and adaptive evolution in exploited fish populations and consequences for their adaptive potential. Evolutionary Applications, 2015, 8(1): 47-63 DOI:10.1111/eva.12220 |
Mollet FM. Evolutionary effects of fishing and implications for sustainable management: A case study of North Seas plaice and sole. Doctoral Dissertation of Wageningen University, 2010
|
Morbey YE, Mema M. Size-selective fishing and the potential for fisheries-induced evolution in lake whitefish. Evolutionary Applications, 2018, 11(8): 1412-1424 DOI:10.1111/eva.12635 |
Musick JA. Criteria to define extinction risk in marine fishes: American fisheries society initiative. Fisheries, 1999, 24(12): 6-14 DOI:10.1577/1548-8446(1999)024<0006:CTDERI>2.0.CO;2 |
Ne HY, Liu JK, Su JP, et al. Progress in the study of animal life history evolution. Acta Ecologica Sinica, 2007, 27(10): 4267-4277 [聂海燕, 刘季科, 苏建平, 等. 动物生活史进化理论研究进展. 生态学报, 2007, 27(10): 4267-4277 DOI:10.3321/j.issn:1000-0933.2007.10.038] |
Neubauer P, Jensen OP, Hutchings JA, et al. Resilience and recovery of overexploited marine populations. Science, 2013, 340(6130): 347-349 DOI:10.1126/science.1230441 |
Olsen EM, Heino M, Lilly GR, et al. Maturation trends indicative of rapid evolution preceded the collapse of northern cod. Nature, 2004, 428(6986): 932-935 DOI:10.1038/nature02430 |
O'Malley KG, Jacobson DP, Kurth R, et al. Adaptive genetic markers discriminate migratory runs of Chinook salmon (Oncorhynchus tshawytscha) amid continued gene flow. Evolutionary Applications, 2013, 6(8): 1184-1194 DOI:10.1111/eva.12095 |
Pardoe H, Vainikka A, Thórdarson G, et al. Temporal trends in probabilistic maturation reaction norms and growth of Atlantic cod (Gadus morhua) on the Icelandic shelf. Journal Canadien Des Sciences Halieutiques et Aquatiques, 2009, 66(10): 1719-1733 DOI:10.1139/F09-132 |
Pauli BD, Heino M. What can selection experiments teach us about fisheries-induced evolution?. Biological Journal of the Linnean Society, 2014, 111(3): 485-503 DOI:10.1111/bij.12241 |
Perez-Rodriguez A, Morgan J, et al. Disentangling genetic change from phenotypic response in reproductive; parameters of Flemish Cap cod Gadus morhua. Fisheries Research, 2013, 138(3): 62-70 |
Philipp DP, Claussen JE, Koppelman JB, et al. Fisheries-induced evolution in largemouth bass: Linking vulnerability to angling, parental care, and fitness. Black Bass Diversity: Multidisciplinary Science for Conservation, 2015, 83: 223-234 |
Philipp DP, Cooke SJ, Claussen JE, et al. Selection for vulnerability to angling in largemouth bass. Transactions of the American Fisheries Society, 2009, 138(1): 189-199 DOI:10.1577/T06-243.1 |
Pinsky ML, Palumbi SR. Meta-analysis reveals lower genetic diversity in overfished populations. Molecular Ecology, 2014, 23(1): 29-39 DOI:10.1111/mec.12509 |
Pukk L, Kuparinen A, Järv L, et al. Genetic and life-history changes associated with fisheries-induced population collapse. Evolutionary Applications, 2013, 6(5): 749-760 DOI:10.1111/eva.12060 |
Quinn TP, Hodgson S, Flynn L, et al. Directional selection by fisheries and the timing of sockeye salmon (Oncorhynchus nerka) migrations. Ecological Applications, 2007, 17(3): 731 DOI:10.1890/06-0771 |
Redpath TD, Cooke SJ, Robert A, et al. Life-history traits and energetic status in relation to vulnerability to angling in an experimentally selected teleost fish. Evolutionary Applications, 2009, 2(3): 312-323 DOI:10.1111/j.1752-4571.2009.00078.x |
Ricker WE. Changes in the average size and average age of Pacific salmon. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38: 1636-1656 DOI:10.1139/f81-213 |
Rijnsdorp AD, Grift RE, Kraak SB. Fisheries-induced adaptive change in reproductive investment in North Sea plaice (Pleuronectes platessa)?. Canadian Journal of Fisheries and Aquatic Sciences, 2005, 62(4): 833-843 DOI:10.1139/f05-039 |
Roff DA. Contributions of genomics to life-history theory. Nature Reviews Genetics, 2007, 8(2): 116-125 DOI:10.1038/nrg2040 |
Rutter C. Natural history of the Quinnat salmon: A report on investigations in the Sacramento River, 1896-1901. Bulletin of the United States Fish Commission, 1902, 22: 65-141 |
Shan XJ, Li ZL, Dai FQ, et al. Seasonal and annual variations in biological characteristics of small yellow croaker Larimichthys polyactis in the central and southern Yellow Sea. Progress in Fishery Sciences, 2011, 32(6): 7-16 [单秀娟, 李忠炉, 戴芳群, 等. 黄海中南部小黄鱼种群生物学特征的季节变化和年际变化. 渔业科学进展, 2011, 32(6): 7-16 DOI:10.3969/j.issn.1000-7075.2011.06.002] |
Silva A, Faria S, Nunes C. Long-term changes in maturation of sardine, Sardina pilchardus, in Portuguese waters. Scientia Marina, 2013, 77(3): 429-438 DOI:10.3989/scimar.03852.03A |
Sinclair AF, Swain DP, Hanson JM. Disentangling the effects of size-selective mortality, density, and temperature on length- at-age. Canadian Journal of Fisheries and Aquatic Sciences, 2002, 59(2): 372-382 DOI:10.1139/f02-014 |
Spangler GR, Payne NR, Thorpe JE, et al. Responses of percids to exploitation. Canadian Journal of Fisheries and Aquatic Sciences, 1977, 34(10): 1972-1982 |
Sun P. A simulation study of impact of trawl selectivity on traits of fish life history. Doctoral Dissertation of Ocean University of China, 2013 [孙鹏.拖网选择性对鱼类生活史性状影响的模拟研究.中国海洋大学博士研究生学位论文, 2013]
|
Sutter DAH, Suski CD, Philipp DP, et al. Recreational fishing selectively captures individuals with the highest fitness potential. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(51): 20960-20965 DOI:10.1073/pnas.1212536109 |
Swain DP. Life-history evolution and elevated natural mortality in a population of Atlantic cod (Gadus morhua). Evolutionary Applications, 2011, 4(1): 18-29 DOI:10.1111/j.1752-4571.2010.00128.x |
Therkildsen NO, Hemmer-Hansen J, Als TD, et al. Microevolution in time and space: SNP analysis of historical DNA reveals dynamic signatures of selection in Atlantic cod. Molecular Ecology, 2013, 22(9): 2424-2440 DOI:10.1111/mec.12260 |
Uusi-Heikkilä S, Savilammi T, Leder E, et al. Rapid, broad-scale gene expression evolution in experimentally harvested fish populations. Molecular Ecology, 2017, 26(15): 3954-3967 DOI:10.1111/mec.14179 |
Uusi-Heikkilä S, Whiteley AR, Kuparinen A, et al. The evolutionary legacy of size - selective harvesting extends from genes to populations. Evolutionary Applications, 2015, 8(6): 597-620 DOI:10.1111/eva.12268 |
Uusi-Heikkilä S, Wolter C, Klefoth T, et al. A behavioral perspective on fishing-induced evolution. Trends in Ecology and Evolution, 2008, 23(8): 419-421 DOI:10.1016/j.tree.2008.04.006 |
van Wijk SJ, Taylor MI, Creer S, et al. Experimental harvesting of fish populations drives genetically based shifts in body size and maturation. Frontiers in Ecology and the Environment, 2013, 11(4): 181-187 DOI:10.1890/120229 |
Walraven LV, Mollet FM, Damme CJGV, et al. Fisheries-induced evolution in growth, maturation and reproductive investment of the sexually dimorphic North Sea plaice (Pleuronectes platessa L.). Journal of Sea Research, 2010, 64(1-2): 85-93 DOI:10.1016/j.seares.2009.07.003 |
Walsh MR, Munch SB, Chiba S, et al. Maladaptive changes in multiple traits caused by fishing: Impediments to population recovery. Ecology Letters, 2006, 9(2): 142-148 DOI:10.1111/j.1461-0248.2005.00858.x |
Wang HY, Höök TO. Eco-genetic model to explore fishing-induced ecological and evolutionary effects on growth and maturation schedules. Evolutionary Applications, 2009, 2(3): 438-455 DOI:10.1111/j.1752-4571.2009.00088.x |
Yang L. Effect of fishing gear and fishing method on benthic community and habitat. Modern Fisheries Information, 2005, 20(3): 15-17 [杨吝. 渔具渔法对底栖群落(Benthic Community)及其栖息地(Habitat)的影响. 渔业信息与战略, 2005, 20(3): 15-17 DOI:10.3969/j.issn.1004-8340.2005.03.005] |
Zhan BY, Lou DC, Zhong JS. An assessment of the filefish population and rational exploitation of the resource. Journal of Fisheries of China, 1986, 10(4): 409-418 [詹秉义, 楼冬春, 钟俊生. 绿鳍马面鲀资源评析与合理利用. 水产学报, 1986, 10(4): 409-418] |
Zhan BY. Fishery resources assessment. Beijing: China Agriculture Press, 1995 [詹秉义. 渔业资源评估. 北京: 中国农业出版社, 1995]
|
Zhang B. Feeding ecology of fishes in the Bohai Sea. Progress in Fishery Sciences, 2018, 39(3): 11-22 [张波. 渤海鱼类的食物关系. 渔业科学进展, 2018, 39(3): 11-22] |
Zhu CD, Zhong S. Biology and fishery significance of fish breeding and conservation in large and medium lakes in China. Fisheries Science and Technology Information, 1979, 8: 2-5 [朱成德, 钟世. 论我国大中型湖泊鱼类资源繁殖保护的生物学及其渔业意义. 水产科技情报, 1979, 8: 2-5] |
Zhu XG, Fang YY, Yan LJ, et al. The ecological strategy evolution of marine fishes under high intensity fishing environment. Bulletin of Science and Technology, 2009, 25(1): 51-55 [朱晓光, 房元勇, 严力蛟, 等. 高捕捞强度环境下海洋鱼类生态对策的演变. 科技通报, 2009, 25(1): 51-55 DOI:10.3969/j.issn.1001-7119.2009.01.010] |
Zhu WJ, Liang ZL, Xu BD. Preliminary study on the trawl fishing induced phenotypic traits selection differential in fish. Transactions of Oceanology and Limnology, 2007(1): 95-102 [朱伟俊, 梁振林, 徐宾铎. 拖网选择性引起的鱼类表型性状选择差的初步研究. 海洋湖沼通报, 2007(1): 95-102] |
Zimmermann F, Jørgensen C. Bioeconomic consequences of fishing-induced evolution: A model predicts limited impact on net present value. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72(4): 612-624 DOI:10.1139/cjfas-2014-0006 |



