Transplants to Different Hydrodynamic Regimes
海草是所有生长于海洋环境中的被子植物的统称,广泛分布于太平洋、印度洋和大西洋沿岸的浅海水域;而海草床是海洋三大典型自然生态系统之一,具有重要的生态功能(吴亚林等, 2018; 张沛东等, 2020; Nordlund et al, 2018)。然而,海草床属于脆弱的生态系统,容易受外界环境变化的影响而发生退化。近年来,由于自然因素(气候变化、自然灾害等)和人类活动(水体污染、渔业捕捞和养殖、旅游开发等)的影响,全球大部分海草床不断衰退(Short et al, 1996; Seddon, 2004),并对海洋生物多样性产生重要的影响(刘金立等, 2021)。为修复业已衰退的海草床,世界各地的生态学家研发了多种可促进海草床恢复的方法和技术,主要包括成体植株移植和种子播种2种方式,其中,尤以鳗草(Zostera marina)床修复的研究和实践最为广泛(van Katwijk et al, 2000)。
虾形草属于鳗草科(Zosteraceae)、虾形草属(Phyllospadix),全球共分布有5种(黄小平等, 2018),主要有红纤维虾形草(Phyllospadix iwatensis)、黑纤维虾形草(P. japonicus)、托利虾形草(P. torreyi)、齿叶虾形草(P. serrulatus)和斯考勒虾形草(P. scouleri),其中,红纤维虾形草和黑纤维虾形草为亚洲的特有种,主要生长在朝鲜半岛、日本沿岸和中国北部沿海地区(Duarte, 2002)。我国山东荣成沿岸曾经有大量的虾形草草床存在。同其他海草一样,虾形草也处在衰退之中。与大多数海草生长于泥沙质海底不同,虾形草主要在岩石基底上生长(曹政飞等, 2015),且往往分布在风浪流较大的海域。由于虾形草雌雄异株,且具有明显的偏雌现象,种子产量很少,因此,难以采用播种方式对衰退的虾形草草床进行修复;而传统的海草植株移植的方法也主要适用于生长于泥沙质海底的鳗草等种类,对岩石底质上生长的虾形草并不适合(Reed et al, 1998)。Park等(2010)为了将移植植株固定在海底,将虾形草植株绑缚在海底水泥构件表面突出的铁钉上,取得了一定效果。
山东荣成马山里海域的红纤维虾形草主要生长在潮间带的潮池和潮下带。该海域位于山东半岛东端,风浪流较强,且海底地形复杂多样,有大量的海底凸起和凹陷,导致海底水动力情况复杂。de Jonge等(2000)在荷兰瓦登海进行鳗草移植项目设计时,将流速当作选址的重要指标之一,速度过大的水域不适宜移植。为探究在该海域进行虾形草移植的可行性,本研究根据海底地形特征设计了一种便于固定虾形草植株的构件进行了移植实验。在潮下带选取了3个不同水动力条件的区域,研究了不同水动力条件下移植的红纤维虾形草存活、形态、生长和生理指标,以期为在不同水动力条件下,通过进行虾形草移植为修复衰退的虾形草草床提供参考。
1 材料与方法 1.1 研究地点实验于2019年4月—2020年8月在山东荣成市马山里海域(37°19.3′N,122°35.3′E)进行(图 1)。马山里海域属于我国黄海海域,是山东半岛沿海诸海域中风速最大的海域之一,年均风速为6.7 m/s,其中,1月平均风速最大,可达8.2 m/s(王永红等, 2000),且为开敞海域,部分潮下带和潮间带的潮池有红纤维虾形草分布。

|
图 1 马山里海域研究区位置示意图 Fig.1 Sketch map of the research area in Mashanli, Shandong, China |
本移植实验在马山里自然海域的潮下带进行,分别选取了高、中、低3个不同水动力条件的岩礁底质区域作为实验点(水深约为0.4 m),并采用石膏球法(Fulton et al, 2005; 杨晓龙等, 2018)测出这3个实验点的水动力条件(高13.6、中7.4、低2.5;数字越高表示波浪和/或水流越强)(图 2)。

|
图 2 石膏球水中暴露实验前后对比 Fig.2 Gypsum spheres before and after the exposure experiment a:实验前;b、c、d分别对应实验后低、中、高水动力条件 a: Before the experiment; b, c and d: After the experiment at low, middle and high hydrodynamic regimes, respectively |
实验区域的水温和光照采用HOBO数据采集器(Onset Computer Corp.,Bourne,MA,美国)监测。这些数据中的温度转换成日均水温(℃),在实验区使用LI-250数据采集器和LI-193SA球形光量子传感器(LI-Co公司, 美国)同步测定水下光照,拟合光照强度(lx)和光合光量子通量密度(photon flux density,PFD,mol photons/m2·s)之间的关系,将HOBO光照和温度数据采集器采集到的光照强度数据转换为PFD,并计算出日PFD (mol photons/m2·d)。
1.3 移植移植在2019年4月进行。移植所用红纤维虾形草均采自潮下带草床区的岩石底质,选取完整、生长良好且株高相近的成体植株,其叶片数均为3~5片,为便于绑缚植株,并使所有植株在移植时处于同一状况,根全部去除,根茎均保留1.5 cm的长度。移植方法:使用棉线将植株捆绑于网孔直径为2 cm的塑料网片上,再将塑料网片通过绑扎带固定于水泥板(25×25 cm)上作为一个移植单元置于锚定框架(40× 40 cm)中,投放到移植海域海底(图 3)。每个移植单元移植虾形草200株,在高、中、低3个不同水动力条件的区域各放置6个移植单元,其中,3个用于监测移植存活率,另外3个用于形态、生长和生理指标的测量。

|
图 3 虾形草水下移植构件 Fig.3 Underwater component assembly for transplanting P. iwatensis |
每隔2个月取样(因新冠疫情,移植后共采样6次,即2019年6、8、10、12月和2020年6、8月)。取样时,移植单元上留存的植株数量与该移植单元上的初始植株数量(200)的比值作为该移植单元的存活率。每个水动力条件组的3个移植单元存活率的平均值作为该水动力条件下的存活率。每次采样时,每个水动力条件组随机采集30株虾形草(包括地上和地下组织),其中,15株用于形态和生长指标的测量,另外15株用于生理指标的测定。
形态指标主要包括株高、叶宽、单株叶面积、根状茎直径、根数目和最大根长。叶片光合色素含量的测定采用萃取法(Dunton et al, 1994):取每株虾形草第2片新叶,先用N, N-二甲基甲酰胺(DMF)提取,然后,使用分光光度计法进行比对测定。以DMF为空白,分别于665、652、649和470 nm处测定吸光值。采用蒽酮法(Lewis et al, 2007)测定虾形草叶和根状茎中的可溶性糖和淀粉含量。
1.5 数据分析运用SPSS 25.0软件对数据进行分析,实验数据均使用双因素方差分析(two-way ANOVA),使用Duncan法分析不同水动力条件下红纤维虾形草存活率、形态及各生理指标的组间差异。使用Origin 2018、ArcGIS10.2软件进行绘图。实验数据采用平均值±标准误差(mean±SE)表示。
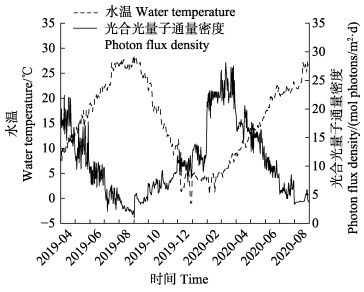
2 结果 2.1 水温和光照实验期间(2019年4月—2020年8月),马山里海域表层水温和光照均呈现明显的季节变化,最低温度(-1.04℃)出现在2019年12月,最高温度(28.58℃)出现在2019年8月。光照度最高值(28.13 mol photons/m2·d)出现在2020年3月,最低值(1.02 mol photons/m2·d)出现在2019年9月初。
|
图 4 山东半岛荣成马山里海域表层水温和光合光量子通量密度随时间的变化 Fig.4 Temporal variations in the temperature and photon flux density in the water column at the study site in Mashanli, Shandong, China |
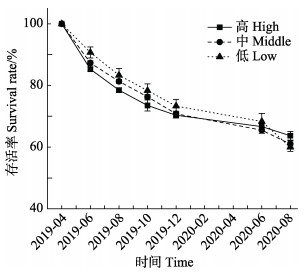
移植后红纤维虾形草植株的存活率呈逐渐下降的趋势。高水动力条件下,红纤维虾形草植株的存活率在实验初期显著低于其他2个水动力条件组(P < 0.05),而在2020年8月时为最高,此时高、中、低3个水动力条件下移植植株的存活率分别为63.7%、61.0%和60.0%。
|
图 5 不同水动力条件下红纤维虾形草移植植株的存活率 Fig.5 Survival rate of surfgrass P. iwatensis transplants under different hydrodynamic regimes |
高水动力和中水动力条件组的株高变化趋势相似,高水动力条件组中的植株在移植后前4个月的株高低于其他处理组,但在移植后的4~ 16个月内均高于其他处理组(图 6a)。高水动力条件组株高的最高值[(65.20±1.89) cm]出现在2020年8月,且显著高于其他月份。其他2个处理组的最高值均在2019年8月;3个处理组的株高最低值[(31.94±1.59) cm]出现在2019年12月时的低水动力条件组。株高随时间的变化,以及与时间和水动力条件之间的交互作用显著(P < 0.001, 表 1)。

|
图 6 不同水动力条件下红纤维虾形草的株高(a)、叶宽(b)、单株叶面积(c)、根状茎直径(d)、最大根长(e)、单株根数量(f) Fig.6 Shoot height (a), leaf width (b), leaf area per shoot (c), rhizome diameter (d), maximum length of roots (e), and number of roots per shoot (f) of surfgrass transplant under different hydrodynamic regimes |
|
|
表 1 不同水动力条件下红纤维虾形草移植植株形态参数时间变化的双因素方差分析 Tab.1 Two-way ANOVA results for the morphological parameter of surfgrass P. iwatensis transplants at different times and different hydrodynamic regimes |
3个水动力条件下,叶宽在移植后呈相似的变化趋势。高水动力条件组的叶宽在移植后均显著高于其他处理组(P < 0.05; 图 6b),其最大值[(2.93±0.09) mm]出现在2019年8月。3个水动力条件组的最低值[高水动力组:(2.47±0.04) mm;中水动力组:(2.17±0.03) mm;低水动力组:(1.91±0.04) mm]均出现在2019年6月。叶宽在不同水动力条件下差异显著(P < 0.001),且其随时间变化及与时间和处理组之间的交互作用显著(P=0.026, 表 1)。
2.3.3 单株叶面积3个水动力条件下的单株叶面积在移植后的变化趋势相似。高水动力条件组的叶面积在移植后各个月中均显著高于其他处理组(P < 0.05, 图 6c)。高水动力条件组中,叶面积的最高值[(33.45±1.98) cm2]出现在2019年8月;其他2个处理组的最高值[(31.00±1.66) cm2]均出现在2019年4月(移植时)。3个处理组的最低值均出现在2019年12月,其中,最低值出现在低水动力条件组[(16.12±0.62) cm2]。单株叶面积在不同月份呈现显著的变化(P < 0.001),且与时间和处理组之间的交互作用显著(P < 0.001,表 1)。
2.3.4 根状茎直径植株移植后,高水动力条件组的根状茎直径均高于其他组,且各组间差异显著(P < 0.001, 图 6d)。根状茎直径随时间变化显著(P < 0.001, 表 1),且高、中、低3个水动力条件组根状茎直径的最高值均出现在2019年6月,分别为(4.88±0.08)、(4.33±0.07)和(4.04±0.13) mm,而最低值分别为(3.70±0.16) mm(2019年4月)、(3.38±0.11) mm (2019年12月)和(2.71±0.04) mm (2019年12月)。
2.3.5 最大根长不同动力条件下,植株的最大根长差异显著(P < 0.001),高水动力条件组的根长均显著高于其他处理组(P < 图 6e)。高、中、低3个水动力条件组根长的最高值均出现在2020年8月,分别为(2.45±0.17)、(1.86±0.07)和(1.57±0.17) cm。其中,中、低水动力条件组的根长的最小值均出现在2019年12月,分别为(1.25±0.08)和(0.99±0.03) cm,而高水动力条件组的最低值出现在移植后的第1次采样时(2019年6月)。
2.3.6 单株根数量3个水动力条件组的植株在移植后,单株根数量的变化呈现相似的趋势,高水动力条件的根数目在各个月均高于其他处理组,且各处理组间差异显著(P < 0.001, 图 6f)。高、中、低3个处理组的最高值均出现在2020年8月,分别为6.2±0.4、5.2±0.4和4.6±0.5,均显著高于其他月份(P < 0.01)。
2.4 移植植株生理 2.4.1 光合色素含量移植后,高水动力条件下叶绿素a含量均高于其他处理组,且不同水动力条件组之间存在显著差异(P < 0.001, 图 7a),其中,最高值[(23.96±1.01) mg/cm2]出现在2019年6月。3个处理组的最低值均出现在2019年12月,低水动力条件组最低[(7.75±0.34) mg/cm2]。叶绿素a含量在不同月份之间存在显著差异(P < 0.001),且与不同水动力条件和月份之间的交互作用显著(P < 0.001, 表 2)。

|
图 7 不同水动力条件下红纤维虾形草的叶绿素a(a)、叶绿素b(b)、类胡萝卜素(c)、总叶绿素(d)含量 Fig.7 Contents of chlorophyll a (a), chlorophyll b (b), carotenoids (c) and total chlorophyll (d) of surfgrass P. iwatensis transplants under different hydrodynamic regimes |
|
|
表 2 不同水动力条件下红纤维虾形草移植植株生理学指标时间变化的双因素方差分析 Tab.2 Two-way ANOVA results for the physiological parameter of surfgrass P. iwatensis transplants at different times and different hydrodynamic regimes |
叶绿素b含量在不同时间均差异显著,且随时间和处理之间交互作用显著(P < 0.001, 表 2)。高水动力条件下,植株的叶绿素b含量在2019年10和12月、2020年6和8月均显著高于其他处理组(P < 0.05, 图 7b)。高水动力条件下,叶绿素b含量的最高值[(11.08±0.27) mg/cm2]出现在2020年8月,显著高于其他月份(P < 0.05)。高、中水动力条件下,叶绿素b含量最低值均出现在2019年12月,分别为(3.63±0.14)和(3.44±0.30) mg/cm2。
移植虾形草的类胡萝卜素含量在不同水动力条件之间差异显著(P < 0.05, 图 7c),最高值出现在高水动力条件组的2020年8月[(5.54±0.13) mg/cm2],显著高于其他月份(P < 0.05)。最低值出现在移植后的第1次采样时的中水动力条件组[(1.80±0.09) mg/cm2],显著低于各个处理组本月以及其他月份(P < 0.05, 表 2)。
总叶绿素含量在不同水动力条件之间差异显著(P < 0.001, 图 7d),移植后,高、中水动力条件均在2019年8月达到最高值,分别为(33.16±0.80)和(29.25±1.38) mg/cm2,而低水动力条件组的最高值[(23.84±0.57) mg/cm2]出现在2020年8月。3个水动力条件下的最低值相近,且均在2019年12月,均显著低于其他月份(P < 0.05),其中,最低值[(11.22±0.22) mg/cm2]出现在低水动力条件组。
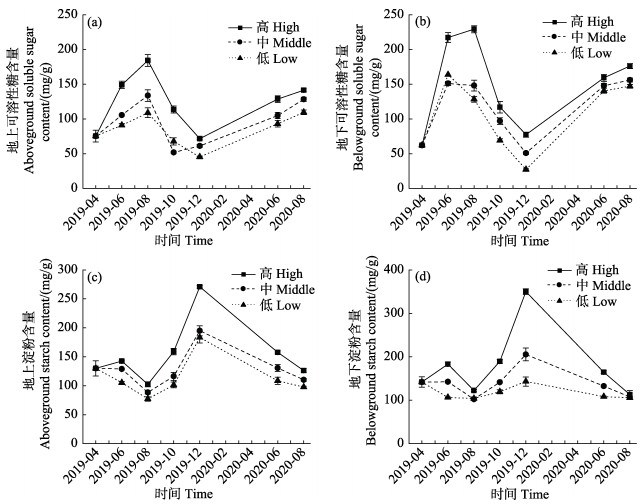
2.4.2 可溶性糖和淀粉含量不同水动力条件下的可溶性糖含量(地上和地下)相比均差异显著,且随时间变化显著,同时,处理组和月份之间的交互作用也差异显著(P < 0.001, 表 2)。地上组织的可溶性糖含量在45.35~184.25 mg/g之间,地下组织的可溶性糖含量为27.30~229.19 mg/g (图 8a和8b)。高水动力条件下的地上和地下可溶性糖含量均高于其他处理组(P < 0.05),其最高值均出现在2019年8月,且显著高于其他月份(P < 0.01);地上和地下组织可溶性糖含量最低值均在低水动力条件组,显著低于其他月份(P < 0.01)。
|
图 8 不同水动力条件下移植红纤维虾形草的可溶性糖和淀粉含量 Fig.8 Contents of soluble sugar and starch in surfgrass P. iwatensis transplants under different hydrodynamic regimes |
植株淀粉含量(地上和地下组织)在不同水动力条件间均差异显著,随时间变化以及不同水动力条件和月份之间的交互作用差异显著(P < 0.001, 图 8c和8d,表 2)。其中,地上组织淀粉含量为77.18~270.91 mg/g,地下组织的淀粉含量为102.48~350.12 mg/g。地上和地下组织的淀粉含量的最高值均在高水动力条件组,且最高值均出现在2019年10月。最低值均出现在低水动力条件组的2019年8月,且显著低于其他月份(P < 0.05)。
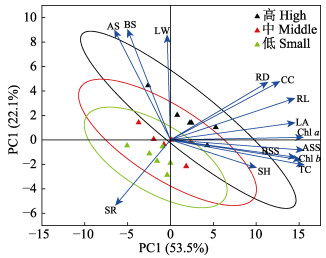
2.5 不同水动力条件与虾形草移植植株各指标的关系水动力条件与红纤维虾形草各项监测指标的PCA排序图(图 9)显示,第1排序轴和第2排序轴累计解释量达75.6%。14个指标中,除地上和地下组织的淀粉含量、存活率和叶宽外,其他指标在第1轴附近聚成一簇,呈较强的相关性,且相关性随矢量夹角的增大而降低;各形态学指标之间、各光合色素之间夹角较小,相互呈现明显的正相关关系;可溶性糖和淀粉含量之间夹角较大,呈较弱的相关关系。
|
图 9 不同水动力条件与红纤维虾形草各项监测指标的PCA排序图 Fig.9 Ordination diagram of PCA of the measurements for the surfgrass P. iwatensis under different hydrodynamic regimes SR:存活率;SH:株高;LW:叶宽;LA:单株叶面积;RD:根状茎直径;RL:根长;Chl a:叶绿素a含量;Chl b:叶绿素b含量;CC:类胡萝卜素含量;TC:总叶绿素含量;ASS:地上可溶性糖含量;BSS:地下可溶性糖含量;AS:地上淀粉含量;BS:地下淀粉含量 SR: Survival rate; SH: Shoot height; LW: Leaf width; LA: Leaf area; RD: Rhizome diameter; RL: Root length; Chl a: Chlorophyll a content; Chl b: Chlorophyll b content; CC: Carotenoid content; TC: Total chlorophyll; ASS: Aboveground soluble sugar; BSS: Belowground soluble sugar; AS: Aboveground starch content; BS: Belowground starch content |
将14个指标的射线延长,3个处理组均垂直投射到射线上,根据投影点到射线实心箭头处相对距离为标准进行排序。结果发现,在高水动力条件下,植株的存活率、形态和生理指标均明显高于其他2个水动力条件组,为虾形草生长最适宜的水动力条件。
3 讨论 3.1 水动力条件对虾形草存活和生长的影响研究表明,水流是影响水生植物形态和生长的重要环境因素之一(Peralta et al, 2006; Villazan et al, 2016)。在进行鳗草移植时,最大的挑战是如何将海草固定在海底,而水流冲击导致移植植株流失是移植失败最重要的原因之一(Bouma et al, 2005)。水流还会改变海草床沉积物的组成,从而影响底质中有机质的含量(Paling et al, 2003),进而对海草的生长产生影响。然而,太强的水流会侵蚀海草床的底质,进而影响海草植株在海底的固着,严重的会导致草床的损失(Riis et al, 2003; 王立志等, 2018)。本研究中,3种水动力条件下移植的虾形草最终均获得60.0%及以上的存活率,说明本研究所采用的移植方法为虾形草植株提供了足够大的固着力,且足以抵抗这3种水动力条件产生的对移植植株的冲击。
研究表明,水流扰动也可促进海底沉积物中营养盐的释放,为海草的生长提供必要的养分,促进其生长(Fonseca et al, 1987);水流还可以减小水体中营养物质在海草叶表面扩散的边界层,从而为海草提供充足的营养(Koch, 1999)。水流还增加海草接受阳光照射的区域,促进海草的光合作用,最终影响海草场的生产力(Paling et al, 2003; Koch et al, 2007)。Koch等(2007)研究了不同流速下泰来草幼苗的生长情况,结果显示,中等流速条件下植株的生物量和叶面积最大。Jordan(2008)研究表明,随着水流流速的增加,鳗草根长会逐渐增加,叶宽逐渐下降,显示了鳗草的生长对水流环境的一种适应机制。Schanz等(2003)研究发现,随水流流速增加,诺氏鳗草(Zostera noltii)株高、叶长和植株密度显著变小。Cooper等(1988)研究了虾形草对岩石底质和水流环境生境的适应性,结果显示,与鳗草相比,虾形草表现出与其特定生境相关的解剖学特征,这些特征包括更发达的皮下纤维和根毛以及更粗大的根茎。本研究中,在高水动力条件下,虾形草的株高、叶鞘长、单株叶面积等的观测值均较高,与Schanz等(2003)对诺氏鳗草的研究结果相反,这可能与2种海草对高水动力环境的适应能力的差异有关;高水动力条件组植株的根状茎直径和根长均高于其他2个低水动力条件组,这与de Los Santos等(2010)研究发现的较强水流会促进诺氏鳗草根茎生长的结果相似。
3.2 水动力条件对虾形草生理的影响尽管关于海草对水中光照、温度、营养盐和CO2等环境因素的生理适应性的研究较多,但海草对水流的响应机制研究很少。Inoue等(2020)在水流对海草光合作用影响的研究中发现,水流会引起海草植株倒伏从而产生自遮阴,进一步影响叶的光合作用。Dennison等(1985、1986)研究发现,鳗草对光照降低的适应策略之一是通过提高光利用率,而其特征就是叶绿素含量的提高。本研究中,高水动力条件组的叶绿素a、叶绿素b、类胡萝卜素含量和叶绿素总含量均高于其他水动力条件组,这可能是虾形草对较大的水流导致其植株倒伏而产生的自遮阴的一种适应策略。
海草能将其叶光合作用产物—非结构性碳水化合物(如葡萄糖、蔗糖和淀粉等)储存起来,而这些碳水化合物在其叶和根茎中的含量将随着光照、水温等环境因子而变化(Burke et al, 1996)。Mass等(2010)研究发现,水流会减小江蓠(Gracilaria cornea)藻体表面扩散边界层厚度,有利于该藻体表面的O2向水体的扩散,促进CO2向藻体表面的扩散,从而提高光合作用效率。本研究中,移植植株的可溶性糖含量和地上组织淀粉含量都在实验结束时在高水动力条件处于最高值,可能得益于该条件下叶表面边界层厚度更小,有利于O2和CO2的流动,再加上具有更高的光合色素含量,从而提高了虾形草碳水化合物的合成和存储,而其机理有待进一步研究。
4 结论本研究中,选取了马山里海域高、中、低3个水动力条件移植红纤维虾形草,并对移植植株的存活率、形态、生长和生理指标进行了为期16个月的监测。结果显示,3种水动力条件下,移植植株在移植16个月后存活率均达到60%以上,但差异不显著;移植植株的其他观测指标之间存在显著差异,且在不同月份之间存在显著变化,其中,以在高水动力条件下的各指标观测值最高。本研究表明,马山里海域的这3种水动力条件均适宜用本研究采用的方法移植虾形草,且以高水动力条件为最佳。
BOUMA T J, DE VRIES M B, LOW E, et al. Trade-offs related to ecosystem engineering: A case study on stiffness of emerging macrophtes. Ecology, 2005, 86(8): 2187-2199 DOI:10.1890/04-1588 |
BURKE M K, DENNISON W C, MOORE K A. Non-structural carbohydrate reserves of eelgrass Zostera marina. Marine Ecology Progress Series, 1996, 137(1/2/3): 195-201 DOI:10.3354/meps137195 |
CAO Z F, ZHANG W, ZHAO H. Morphology and anatomy of Phyllospadix iwatensis makino and their adaptation to marine environment. Oceanologia et Limnologia Sinica, 2015, 46(6): 1326-1332 [曹政飞, 张伟, 赵宏. 红纤维虾海藻(Phyllospadix iwatensis)形态结构特征及其对海洋环境的适应性. 海洋与湖沼, 2015, 46(6): 1326-1332] |
COOPER L W, MCROY C P. Anatomical adaptations to rocky substrates and surf exposure by the seagrass genus Phyllospadix. Aquatic Botany, 1988, 32(4): 365-381 DOI:10.1016/0304-3770(88)90108-8 |
DE JONGE V N, DE JONG D J, VAN KATWIJK M M. Policy plans and management measures to restore eelgrass (Zostera marina L.) in the Dutch Wadden Sea. Helgoland Marine Research, 2000, 54(2/3): 151-158 DOI:10.1007/s101520050013 |
DE LOS SANTOS C B, BRUN F G, BOUMA T J, et al. Acclimation of seagrass Zostera noltii to co-occurring hydrodynamic and light stresses. Marine Ecology Progress Series, 2010, 398(6): 127-135 DOI:10.3354/meps08343 |
DENNISON W C, ALBERTE R S. Photoadaptation and growth of Zostera marina L. (eelgrass) transplants along a depth gradient. Journal of Experimental Marine Biology and Ecology, 1986, 98(3): 265-282 DOI:10.1016/0022-0981(86)90217-0 |
DENNISON W C, ALBERTE R S. Role of daily light period in the depth distribution of Zostera marina (eelgrass). Marine Ecology Progress Series, 1985, 25(1): 51-61 DOI:10.3354/meps025051 |
DUARTE C M. The future of seagrass meadows. Environmental Conservation, 2002, 29(2): 192-206 DOI:10.1017/S0376892902000127 |
DUNTON K H, TOMASKO D A. In situ photosynthesis in the seagrass Halodule wrightii in a hypersaline subtropical lagoon. Marine Ecology Progress Series, 1994, 107(3): 281-293 DOI:10.3354/meps107281 |
FONSECA M S, KENWORTHY W J. Effects of current on photosynthesis and distribution of seagrasses. Aquatic Botany, 1987, 27(1): 59-78 DOI:10.1016/0304-3770(87)90086-6 |
FULTON C J, BELLWOOD D R. Wave-induced water motion and the functional implications for coral reef fish assemblages. Limnology and Oceanography, 2005, 50(1): 255-264 DOI:10.4319/lo.2005.50.1.0255 |
HUANG X P, JIANG Z J, ZHANG J P, et al. The Chinese nomenclature of the global seagrasses. Acta Oceanologica Sinica, 2018, 40(4): 127-133 [黄小平, 江志坚, 张景平, 等. 全球海草的中文命名. 海洋学报, 2018, 40(4): 127-133 DOI:10.3969/j.issn.0253-4193.2018.04.012] |
INOUE Y, TERADA R, BELLEZA D F C, et al. Effect of water velocity on the physiology of a collapsing Sargassum siliquastrum canopy under a controlled environment. Phycological Research, 2020, 68(4): 313-322 DOI:10.1111/pre.12437 |
JORDAN T L. Acclimation of two marine macrophytes (Saccharina latissima and Zostera marina) to water flow. Masterxs Thesis of University of Maryland, 2008
|
KOCH E W. Preliminary evidence on the interdependent effect of currents and porewater geochemistry on Thalassia testudinum Banks ex König seedlings. Aquatic Botany, 1999, 63(2): 95-102 DOI:10.1016/S0304-3770(98)00116-8 |
KOCH M S, SCHOPMEYER S, KYHN-HANSEN C, et al. Synergistic effects of high temperature and sulfide on tropical seagrass. Journal of Experimental Marine Biology and Ecology, 2007, 341(1): 91-101 DOI:10.1016/j.jembe.2006.10.004 |
LEWIS M A, DANTIN D D, CHANCY C A, et al. Florida seagrass habitat evaluation: A comparative survey for chemical quality. Environmental Pollution, 2007, 146(1): 206-218 DOI:10.1016/j.envpol.2006.04.041 |
LIU J L, CHEN X J. Research progress and hotspots of marine biodiversity: Based on bibliometrics and knowledge mapping analysis. Progress in Fishery Sciences, 2021, 42(1): 201-213 [刘金立, 陈新军. 海洋生物多样性研究进展及其热点分析. 渔业科学进展, 2021, 42(1): 201-213] |
MASS T, GENIN A, SHAVIT U, et al. Flow enhances photosynthesis in marine benthic autotrophs by increasing the efflux of oxygen from the organism to the water. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(6): 2527-2531 DOI:10.1073/pnas.0912348107 |
NORDLUND L M, JACKSON E L, NAKAOKA M, et al. Seagrass ecosystem services - Whatxs next?. Marine Pollution Bulletin, 2018, 134: 145-151 DOI:10.1016/j.marpolbul.2017.09.014 |
PALING E I, VAN KEULEN M, WHEELER K D, et al. Influence of spacing on mechanically transplanted seagrass survival in a high wave energy regime. Restoration Ecology, 2003, 11(1): 56-61 DOI:10.1046/j.1526-100X.2003.00072.x |
PARK J I, LEE K S. Development of transplantation method for the restoration of surfgrass, Phyllospadix japonicus, in an exposed rocky shore using an artificial underwater structure. Ecological Engineering, 2010, 36(4): 450-456 DOI:10.1016/j.ecoleng.2009.11.012 |
PERALTA G, BRUN G, PEREZ-LLORENS J L, et al. Direct effects of current velocity on the growth, morphometry and architecture of seagrasses: A case study on Zostera noltii. Marine Ecology Progress Series, 2006, 327: 135-142 DOI:10.3354/meps327135 |
REED D C, HOLBROOK S J, SOLOMON E, et al. Studies on germination and root development in the surfgrass Phyllospadix torreyi: Implications for habitat restoration. Aquatic Botany, 1998, 62(2): 71-80 DOI:10.1016/S0304-3770(98)00088-6 |
RIIS T, BIGGS B J F. Hydrologic and hydraulic control of macrophyte establishment and performance in streams. Limnology and Oceanography, 2003, 48(4): 1488-1497 DOI:10.4319/lo.2003.48.4.1488 |
SCHANZ A, ASMUS H. Impact of hydrodynamics on development and morphology of intertidal seagrasses in the Wadden Sea. Marine Ecology Progress Series, 2003, 261(8): 123-134 DOI:10.3354/meps261123 |
SEDDON S. Going with the flow: Facilitating seagrass rehabilitation. Ecological Management and Restoration, 2004, 5(3): 167-176 DOI:10.1111/j.1442-8903.2004.00205.x |
SHORT F T, WYLLIE-ECHEVERRIA S. Natural and human-induced disturbance of seagrasses. Environmental Conservation, 1996, 23(1): 17-27 DOI:10.1017/S0376892900038212 |
VAN KATWIJK M M, HERMUS D C R. Effects of water dynamics on Zostera marina: Transplantation experiments in the intertidal Dutch Wadden Sea. Marine Ecology Progress Series, 2000, 208: 107-118 DOI:10.3354/meps208107 |
VILLAZáN B, BRUN G F, GONZáLEZ-ORTIZ V, et al. Flow velocity and light level drive non-linear response of seagrass Zostera noltii to ammonium enrichment. Marine Ecology Progress Series, 2016, 545: 109-121 DOI:10.3354/meps11631 |
WANG L Z, DONG B, SONG H L. Growth indexes and their difference of Hydrilla verticillata under change of flow velocities of simulated water flow. Wetland Science, 2018, 16(2): 138-143 [王立志, 董彬, 宋红丽. 模拟水流流速变化下黑藻生长指标及其差异. 湿地科学, 2018, 16(2): 138-143] |
WANG Y H, ZHUANG Z Y, LI X L. The calculation of along shore silt discharge rates and evolution development of sands pint in the Rongcheng Bay, Shandong Peninsula. Marine Geology and Quaternary Geology, 2000, 20(4): 31-35 [王永红, 庄振业, 李学伦. 山东荣成湾沿岸输沙率及沙嘴的演化动态. 海洋地质与第四纪地质, 2000, 20(4): 31-35] |
WU Y L, GAO Y P, LÜ X N, et al. Ecological contribution of Ruditapes philippinarum in the seagrass meadow of Sanggou Bay. Progress in Fishery Sciences, 2018, 39(6): 126-133 [吴亚林, 高亚平, 吕旭宁, 等. 桑沟湾楮岛大叶藻床区域菲律宾蛤仔的生态贡献. 渔业科学进展, 2018, 39(6): 126-133] |
YANG X L, LÜ H B, HU C Y, et al. Spatial-temporal variations of benthic macroalgae and their responses to variations in the environment in the artificial reef zones of Laoshan Bay. Journal of Fishery Sciences of China, 2018, 25(3): 642-653 [杨晓龙, 吕洪斌, 胡成业, 等. 崂山湾人工礁区大型底栖海藻时空格局及对环境变化的响应. 中国水产科学, 2018, 25(3): 642-653] |
ZHANG P D, ZHANG Y H, ZHANG H Y, et al. Research advances in shoot propagation theory and planting technique of seagrasses. Progress in Fishery Sciences, 2020, 41(4): 181-189 [张沛东, 张彦浩, 张宏瑜, 等. 海草植株扩繁理论及其定植效应的研究进展. 渔业科学进展, 2020, 41(4): 181-189] |



