2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
4. 山东长岛近海渔业资源国家野外观测研究站 山东 烟台 265800
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Shandong Provincial Key Laboratory of Fishery Resources and Ecological Environment, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao, Shandong 266071, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
4. National Field Observation and Research Center for Fisheries Resources in Changdao Waters, Yantai, Shandong 265800, China
人类进入工业时代以来,生产力水平不断提高,同时也产生了许多的生态环境问题,其中,温室气体导致的气候变化尤为突出(Metz et al, 2001)。CO2作为主要的温室气体,不仅对全球气温升高的贡献达到了70%,还造成了海洋酸化等一系列环境问题(Melillo et al, 1990)。近年来,世界各国对减少CO2排放和增加碳汇越来越重视(刘慧等, 2011)。海洋作为地球上最大的碳库,在全球碳循环和碳汇过程中都发挥着极其重要的作用(刘纪化等, 2015)。全球大气中,近90%的CO2会进入海洋中参与碳循环,其中一部分碳被长期封存在海洋中,从而形成了海洋碳汇(Nellemann et al, 2009)。海洋中不同来源碳的一条重要碳汇途径是通过食物网向生物资源传递,这部分碳维持了海洋生物的生命活动(Jiao et al, 2010)。生产者、无脊椎动物和鱼类产生的颗粒碳沉降至海底,形成海洋生物碳泵(焦念志等, 2016)。一部分碳传递到渔业资源后,通过捕捞或收获移出了海洋体系,被称为碳汇渔业,其实质也是海洋生物碳汇(唐启升, 2010)。人为导致的气候变化和人类活动(捕捞、养殖、航运等)造成了海洋环境的恶化,如富营养化、酸化、海洋生产力下降、生物多样性降低、食物网结构转变和资源枯竭等,极大地影响了海洋生物碳汇的能力(宋金明, 2003)。因此,如何在保证海洋优质食物资源产出的同时,保护海洋资源环境,增加海洋碳汇,实现可持续发展,成为碳汇渔业的重要研究问题。
陆架边缘海虽然面积较小,但由于该区域接纳了各种上升流、沿岸流和河流带来的碳和营养盐,不仅承载了大量海洋生物的生命活动,而且在碳循环中也发挥着重要作用(陈泮勤, 2004)。近岸岛屿毗邻海域作为陆架边缘海中最具代表性的区域之一,是重要的海–陆过渡区域,并且受人类活动影响巨大(如养殖、捕捞、船运、河流、陆源物质输入等),具有复杂的碳来源输入,其碳来源尚不明确,是研究海洋碳汇和碳汇渔业的理想区域。经典食物链是连接碳来源与碳汇的重要通道,但目前对生物在近海碳循环过程中作用的了解依旧不足,关于近岸岛屿毗邻海域海洋食物网中碳汇的具体途径研究仍然比较匮乏。因此,厘清近岸岛屿毗邻海域食物网中不同的碳来源对消费者的贡献,有助于进一步认识海洋生物碳汇的途径和过程,深入了解海–陆相互作用过程中的碳循环机制,促进制定更加合理的碳汇渔业管理策略。
本研究以2020年秋季在庙岛群岛毗邻海域采集的生产者和消费者为研究对象,通过碳氮稳定同位素分析方法和贝叶斯混合模型SIAR (stable isotope analysis in R),评估初级生产者中不同的碳来源对消费者的相对贡献,并以此对碳汇渔业展开深入讨论,为进一步定量研究海洋鱼类的碳汇能力提供一种研究思路,以期对相关研究提供理论和数据支持。
1 材料与方法 1.1 研究区域和采样方法庙岛群岛又称长岛,位于中国北部的渤海海峡,是黄渤海的交汇处(图 1),具有完整的生态系统,包括海域、潮间带和海岛,生物资源丰富(Shen et al, 2016)。岛屿南部靠近山东半岛,是重要的航运通道,且岛屿周边存在大量的贝类养殖区域,海域受人为活动影响较大,具有明显的海–陆相互作用(Chi et al, 2017)。过去,由于人类活动和气候变化的影响,庙岛群岛海域的生态环境和渔业资源受到了一定的影响。近年来,随着长岛海洋生态文明试验区的成立,亟需对该区域展开生态环境和生物资源的调查研究,促进海洋生态环境的恢复和保护,增加海洋碳汇能力。此外,复杂的人为活动和海–陆相互作用也为研究海洋碳汇和碳汇渔业提供了理想的研究区域。
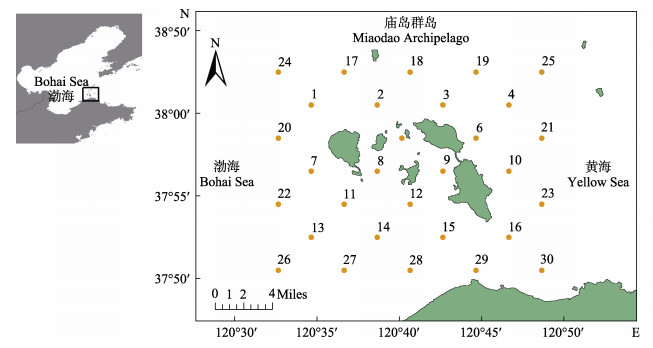
|
图 1 庙岛群岛采样站位 Fig.1 The location and sampling stations of the Miaodao Archipelago |
本研究于2020年9月对庙岛群岛(120.5°°~ 120.8°E,37.8°~38.0°N)展开调查,共设30个采样站位(图 1)。野外采样主要包括海底底质有机质(SOM)、悬浮颗粒有机物(POM)、藻类(浮游植物、大型藻类)、浮游动物、水生无脊椎动物和鱼类。
采用抓斗式采泥器定点垂直采集表层沉积物样本(约1~2 cm),并在−20℃下冷冻,待下一步处理。使用2.5 L采水器采集2 L表层海水,使用80目孔径的筛绢过滤,所得滤液抽滤至经500℃预灼烧5 h的Whatman GF/F玻璃纤维过滤膜上,得到POM样品(Kohlbach et al, 2016)。用锡纸包裹过滤膜,–20℃密封袋保存,直到进一步分析。此外,采用阿氏网采集大型藻类样品,–20℃冷冻保存。用标准的小型生物网从水底定点垂直拖网至水面采集浮游植物。首先用200 μm的筛绢过滤样品中的浮游动物,再通过粒径分别为100 μm和20 μm的筛绢筛选浮游植物。浮游植物样本通过泵系统收集在Whatman GF/F玻璃纤维滤膜上, 并用锡箔包好置于−20℃冰箱中存储(刘华雪等, 2015a)。浮游动物通过垂直拖网从水底采集到水面,在盛有过滤海水的桶中静置2 h,以排空浮游动物的胃含物。用筛绢将浮游动物分为4个粒级:> 900、500~900、300~500和100~300 μm。用蒸馏水反复冲洗筛绢后,用Whatman GF/F滤膜采集4种浮游动物样本(刘华雪等, 2015b)。滤膜用锡纸包裹,在–20℃冰箱中保存。利用抓斗式采泥器和阿氏网在30个站点采集无脊椎动物和鱼类。采集后,在–20℃保存,带回实验室进行物种鉴定、体长和体重测量,并进一步进行稳定同位素分析。
1.2 稳定同位素分析动物的组织(如肌肉)反映了关于食物选择的长期信息(Qu et al, 2019; McIntyre et al, 2006)。因此,收集并分析鱼类的白色背部肌肉,虾类取其腹部肌肉,蟹类取其第1鳌足肌肉,头足类取其腕部肌肉,螺类去壳取肌肉,贝类取闭壳肌。对于其他较小无脊椎动物,如没有足够白色肌肉组织,将整个个体用于稳定同位素分析。在对SOM样品和整个个体的小型甲壳类进行δ13C分析之前,首先对样品进行处理以去除无机碳的影响(Post et al, 2002)。将这些同位素样品分为2份,一份利用1 mol/L HCl处理以溶解用于δ13C分析的CaCO3,另一份直接用于δ15N分析(Kanaya et al, 2007)。单细胞浮游植物通过吞噬不加选择地摄入食物,因此,对由几个种类组成的混合浮游植物样本进行分析。用蒸馏水清洗藻类的茎和叶,用于稳定同位素分析。在实验室制备后,所有样品在60℃下烘干48 h,直至恒重。干燥的样品经过球磨仪研磨处理,装入锡舟后进行稳定同位素分析。
所有同位素样品均由中国科学院武汉水生生物研究所的元素分析仪和同位素比值质谱仪测定。δ13C和δ15N同位素分析的参考材料分别为VPDB (Pee Dee Belemnite)和N2。国际标准材料为IAEA-USGS24和IAEA-USGS25。稳定同位素比值用标准δ符号表示(δ13C和δ15N),定义为:
| $ \Delta R=\left[\left(X_{\text {sample }}-X_{\text {standard }}\right) / X_{\text {standard }}\right] \times 10^{3}(‰) $ | (1) |
式中,R代表13C或15N,X代表13C/12C或15N/14N。碳、氮同位素值的分析精度分别优于0.1‰和0.2‰。
采用以下方程计算氮同位素的富集因子Δ15N:
| $ \Delta^{15} \mathrm{~N}=5.92-0.27 P $ | (2) |
式中,P为消费者的δ15N值。
本研究选取浮游动物作为基线生物。
1.3 数据分析使用R语言(R4.0.5)中的“SIAR”包可以估计多个来源对不同消费者的贡献。本研究利用稳定同位素(δ13C和δ15N)和siarmcmcdirichletv4命令估算庙岛群岛毗邻海域食物网中不同的碳来源对消费者的相对贡献。本研究碳同位素营养富集因子(TEF)为Δ13C:(1.0±0.4)‰。计算每个消费者Δ15N的平均值和标准差(Mean±SD),对主要分类类群中所有物种的富集因子进行平均,得到氮同位素营养富集因子。在使用该模型之前,进行Kruskal-Wallis分析,确保不同碳来源之间的同位素值存在差异。
所有统计分析和数据可视化均使用R4.0.5和Origin 2021软件进行。
2 结果 2.1 样品描述本次庙岛群岛毗邻海域调查研究共采集到生物种类60种,以底栖无脊椎动物居多,达34种,鱼类26种;所有样品中鱼类占37.11%,虾类占9.64%,蟹类占12.63%,头足类占12.79%,其他种类占27.83%。
2.2 食物网各组分的稳定同位素值2021年秋季,庙岛群岛毗邻海域潜在碳来源主要包括浮游植物、大型藻类POM和SOM,其δ13C值为–26.54‰ ~ –16.92‰,分布范围较广,其同位素比见表 1所示。δ15N范围为0.38‰ ~ 8.58‰。利用Kruskal-Wallis分析来检验不同碳来源间碳氮稳定同位素比值的显著性差异,结果显示,各碳来源间碳氮同位素比值间存在显著差异(P < 0.05)。
|
|
表 1 潜在碳来源的δ13C和δ15N值 Tab.1 Values of δ13C and δ15N for the potential carbon sources |
2021年秋季,庙岛群岛毗邻海域的消费者主要为无脊椎动物和鱼类,按照其食性划分为4种消费者类群,分别为底栖无脊椎动物、杂食性鱼类、底栖食性鱼类和肉食性鱼类。底栖无脊椎动物的δ13C范围为–25.43‰~ –16.74‰,δ15N范围为2.84‰~13.06‰;鱼类δ13C范围为–22.26‰~–15.10‰,δ15N范围为7.35‰~14.54‰。利用Kruskal-Wallis分析来检验不同消费者类群间碳氮稳定同位素比值的显著性差异,结果显示,各消费者类群间碳氮同位素比值间均存在显著差异(P < 0.05)。
如图 2所示,潜在碳来源的δ13C值分布范围较广,基本涵盖了消费者的δ13C值范围,而δ15N值呈明显的阶梯分层分布,最下层为潜在碳来源,往上是无脊椎动物,最上层是鱼类。
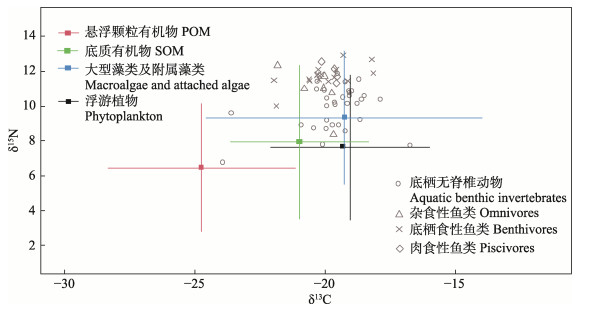
|
图 2 庙岛群岛毗邻海域主要生物δ13C−δ15N(平均值±标准差)的二维分布 Fig.2 Two-dimensional distribution of δ13C−δ15N (mean±SD) of main biological species in the waters around the Miaodao Archipelago |
基于4种碳来源的SIAR模型计算结果表明,以底栖生物为主的水生无脊椎动物的食物碳来源主要为大型藻类,贡献约为(63±11)%,其次是SOM和浮游植物,分别贡献了(18±11)%和(15±10)%,POM贡献最低,为(4±3)%。杂食性鱼类的主要碳来源相对平均,不同碳来源对其食物中碳的贡献比例较为均衡,主要为SOM、大型藻类及附着藻类和浮游植物,其贡献分别为(29±14)%、(29±13)%和(28±13)%,POM的贡献最低,但达到(14±8)%。以底栖生物食性为主的鱼类的主要碳来源依次为大型藻类、SOM和浮游植物,其贡献分别为(36±11)%、(29±13)%和(28±13)%,POM贡献较低,仅为(7±5)%。肉食性鱼类主要包括长体蛇鲻(Saurida elongate)、中国花鲈(Lateolabrax maculatus)、褐菖鲉(Sebasticus marmoratus)、许氏平鲉(Sebastes schlegelii)等食性较为凶猛的鱼类,游泳能力较强,活动范围广泛,以摄食鱼、虾、蟹类为主,其中,碳来源贡献最高的为浮游植物,达到(32±14)%,其次为大型藻类和SOM,贡献分别为(29±13)%和(27±14)%,最低为POM,贡献为(12±8)%。总体来看,庙岛群岛毗邻海域的消费者主要碳来源为浮游植物、SOM和大型藻类及附着藻类,POM对消费者碳来源的贡献较低,只有4%~14%左右(图 3)。
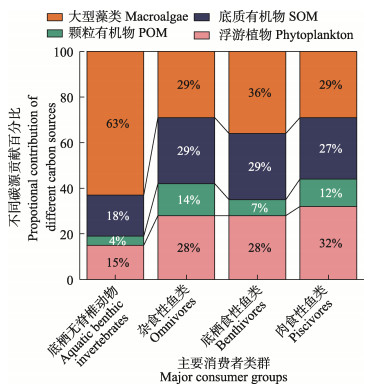
|
图 3 不同碳来源对主要消费者的相对贡献 Fig.3 Relative contribution of different carbon sources to major consumers |
近岸岛屿毗邻海域具有十分明显的海陆相互作用,其碳来源主要分为内源碳和外源碳。内源碳主要包括浮游植物、大型藻类及附着藻类和部分SOM,外源碳主要包括POM和部分SOM。本研究中,POM的δ13C变化范围为–26.54~ –22.29,平均值为(–25.14± 1.24),碳同位素比率较低,根据碳同位素模式,POM符合陆相模式(Darnaude et al, 2005),主要构成为陆源物质,这里近似将POM看作外源碳。SOM的构成比较复杂,主要包括POM沉降、浮游植物死后沉降、大型藻类和水生动物死后形成的碎屑等。对SOM的来源组成进一步分析的结果显示,外源性POM沉降对SOM碳来源的贡献值约为40%,其余内源性碳来源贡献分别为浮游植物42%、大型藻类碎屑12%、动物碎屑6%。
结合POM和SOM中外源性碳对主要碳来源进行内外碳来源贡献分析。如图 4所示,内源碳为庙岛群岛毗邻海域消费者的主要碳来源,贡献率在74%~89%之间;外源碳贡献率较低,仅为11%~26%。其中,外源碳对杂食性鱼类食物碳来源贡献最高(26%),其次为肉食性鱼类(23%),底栖食性鱼类为19%,对水生无脊椎动物的碳来源贡献最低(11%)。

|
图 4 内外碳来源对主要消费者的相对贡献 Fig.4 Proportional contribution of autochthonous and allochthonous carbon to consumers |
生态系统所捕获的生物碳中,有超过50%的碳是由海洋生物所捕获的,海洋生物在碳汇过程中发挥着十分重要的作用(Nellemann et al, 2009)。已知具有重要碳汇功能的海洋生物类群主要有浮游生物、大型藻类、细菌、贝类、海草、红树林和珊瑚礁生态系统等,以生产者的固碳作用和贝类的钙化作用为主(吕为群等, 2012)。而海洋食物网中的消费者,如海洋鱼类、无脊椎动物等在海洋碳汇中的作用往往被低估,许多碳汇过程及其影响因素仍需进一步研究。
3.1 食物网的潜在碳来源分析有关近海生态系统食物网的研究表明,浮游植物、大型藻类及附着藻类、POM和SOM是驱动食物网的主要碳来源(Weitere et al, 2005)。本研究中,浮游植物、大型藻类和SOM是食物网的主要碳来源,以POM和部分SOM为主的外源碳贡献较低,表明海洋无脊椎动物和海洋鱼类主要利用来自海洋的内源性碳,如浮游植物、大型藻类光合作用产生的有机碳。与淡水生态系统明显不同(郑圆圆, 2018; 李云凯等, 2014),近岸岛屿虽然同样受人为活动和海–陆相互作用影响较大,但食物网的碳来源仍然以海洋为主。这与其他研究人员的研究结果基本一致,蔡德陵等(1999)在崂山湾进行水体生物食物网调查时发现,浮游植物碳是其主要来源;谢斌等(2017)在利用稳定同位素研究春季海州湾海洋牧场海域食物网时,同样发现浮游植物是海洋牧场拖网渔获物的重要碳来源之一,贡献平均值达到80.8%,而POM的贡献相对较低,仅为8.4%;高世科等(2021)在对2018年夏季吕泗渔场近岸海域主要生物种类的潜在碳来源研究中同样发现,浮游植物和SOM是生物种类的主要碳来源,POM的贡献较小;魏虎进等(2013)在研究象山港海洋牧场食物网时发现,大型藻类是重要碳来源,贡献达到35.5%, ,而浮游植物和SOM是食物网的基础碳来源,相对其他碳来源,POM的相对贡献率最小。
浮游植物是海洋重要的初级生产者,其稳定同位素组成主要来自海水中的溶解无机碳,是海洋食物网的基础(Gillikin et al, 2006)。本研究相较以往研究,浮游植物的碳来源贡献略低,可能是由于浮游植物更容易受到环境条件变化的影响,例如,由金属元素、温度、海流和营养盐浓度引起的变化(Mills et al, 2012)。研究表明,大型藻类密集养殖可能会抑制浮游植物的生长,并且与浮游植物竞争营养资源,从而降低浮游植物的生物量,减少其碳来源的贡献(Xie et al, 2021)。另外,养殖贝类的存在可能也在一定程度上影响浮游植物的丰度。
SOM作为食物网的基础碳来源,由于其不易受到干扰,具有一定的稳定性,但其来源比较复杂,主要包括内源性碳的沉降,如动物尸体、碎屑、粪便、藻类的碎屑尸体等,也有外源性的碳沉降,如来自陆地和人类活动产生的POM输入(Miyatake et al, 2014)。本研究中,SOM的构成主要为内源性碳,是底栖生物的基础碳来源。
近岸岛屿生态系统的一大特点是具有丰富的海藻资源,大型海藻不仅通过光合作用为食物网提供了大量的初级生产力,也为海洋生物提供了生存与活动的栖息环境(何培民等, 2015)。过去,对于大型藻类、盐沼植物和底栖微藻等初级生产者的重要性长期存在争论,越来越多的研究表明,大型藻类在近岸海域生物食物网中占有重要的地位(Currin et al, 1995)。Vizzini等(2003)研究发现,在地中海沿岸的Sabaudia潟湖中,大型藻类是底栖消费者的主要食物源。Magni等(2008)在意大利Santa Giusta潟湖的研究发现,消费者的食物来源以大型海藻为主。魏虎进等(2013)在对象山港海洋牧场区域食物网进行研究时发现,大型藻类是消费者的重要碳来源。本研究中,大型海藻是庙岛群岛毗邻海域近岸底栖食物网的主要碳来源之一,尤其是对底栖水生无脊椎动物的贡献明显高于鱼类,这主要是因为在底栖水生无脊椎动物中存在许多直接或间接以藻类为食的头足类、甲壳类以及棘皮动物等生物资源,这些无脊椎动物通过啃食作用将初级生产力向上传递。除此之外,藻类产生的碎屑还会通过微食物环和生物摄食进入食物网中。
3.2 藻类碳来源与碳汇本研究中,藻类主要包括浮游植物和大型藻类,是海洋生态系统中的主要初级生产者。藻类对庙岛群岛毗邻海域的水生无脊椎动物、杂食性鱼类、底栖食性鱼类和肉食性鱼类的碳来源贡献分别达78%、57%、64%和61%。由此可见,藻类是驱动岛屿毗邻海域海洋食物网的最重要碳来源。
浮游植物的生长非常快速,支撑着海洋中从浮游动物到顶级捕食者的复杂食物链(孙军, 2011)。浮游植物作为食物来源,不仅是食物网中消费者的重要碳来源,也是海洋中重要的碳汇组成部分。其中,硅藻(Diatom)和颗石藻(Coccolithophore)是对海洋生物碳汇具有重要影响的2种浮游植物类群(孙军, 2007)。硅藻的硅质外壳和颗石藻的钙质颗石粒难溶于水且易于快速沉降,死后的硅藻和颗石藻通过物理沉降形成了很高的生物碳汇(赵相伟, 2020)。海水的富营养化通常会造成甲藻(Dinoflagellates)集中暴发,大量的甲藻会占据硅藻或颗石藻的生态位,极大地降低硅藻和颗石藻的碳汇能力(王世浩, 2019)。浮游植物的另外一条重要碳汇途径是通过经典的食物链向渔业资源生物传递,所有的初级消费者和次、顶级消费者都直接或间接以浮游植物为食,这部分碳用于渔业资源生物自身生长繁殖活动,经捕捞和收获被移出海洋生态系统(Sun, 2011)。
在以往的驱动食物网的碳来源贡献研究中,大多以浮游植物研究为主。谢斌等(2017)、高世科等(2021)只选取浮游植物、POM和SOM为潜在碳来源,受到采样条件和研究区域的限制,往往忽视了大型藻类对食物网的贡献,大大低估了大型藻类的碳来源与碳汇能力。大型海藻可以通过光合作用将水体中溶解的无机碳和大气中的CO2转化为有机碳,是近海海洋初级生产力的重要组成部分,其产生的有机碳不仅作为碳来源支撑起了食物网,还可以通过自身存储或埋藏于沉积物的方式形成碳汇,是海洋碳循环的重要一环(冯子慧等, 2012)。本研究中,大型藻类对底栖的水生无脊椎动物消费者类群(如贝类、海胆、虾蟹类)的碳来源贡献较高且明显高于鱼类,进一步说明大型藻类不仅在自身固碳、储碳过程中发挥巨大作用,在驱动海洋食物网方面可能同样发挥着一定的作用。但由于过度开采、围海造田等破坏海岸带的开发行为,近海的海底与沿岸受到不同程度的破坏,导致天然的大型藻类丰度锐减(FAO, 2009)。针对这一情况,我国已经开始推进大型海藻的保护与恢复,例如人工岛礁建设和天然海藻修复(姜宏波等, 2009)。大型海藻的合理增养殖对增加海洋碳汇具有重要作用。基于本研究结果,大型海藻的增养殖不仅可以极大地提升近海海域对CO2的吸收量,还有可能通过对食物网中消费者的碳来源支持,进而将一定的生物碳移除水体,实现碳汇渔业。本研究中,大型藻类对以贝类为主的底栖无脊椎动物的碳来源贡献率较高,在大型海藻养殖中增加贝类等无脊椎动物或将以贝、藻为食的鱼类等进行混合养殖,不仅能优化养殖结构、增加经济收入,还可以通过藻类对贝类或以贝、藻为食的鱼类的大量碳来源支撑,从而增加生物碳的固定量并提高碳汇(李娇等, 2013)。但大型藻类丰度的增加可能会与浮游植物争夺营养资源,导致浮游动物丰度下降,进一步影响鱼类的食物来源,因此,需合理科学地进行藻类增养殖。
3.3 海洋鱼类的固碳途径与碳汇渔业海洋鱼类通过摄食将有机碳一部分转化成自身成分,一部分通过呼吸作用排入水体,剩余部分形成碎屑沉降至海底(朱骅, 2019)。本研究中,鱼类的主要碳来源为藻类,其次为SOM,POM的贡献最低。不同鱼类的碳来源受其食性和活动空间的影响。底栖鱼类的碳来源主要为浮游植物、大型藻类和SOM,而活动范围更广的鱼类的外源性碳占比相对有所增加。虽然庙岛群岛海域受到人类活动和陆源物质的影响,但鱼类的碳来源仍然以内源碳为主,表现出海洋的碳同位素特征。碳汇渔业是指通过渔业生产活动促进水生生物吸收水体中的CO2,通过收获这些生物将碳移出水体,使碳被再利用或储存。然而,目前对生物在近海食物网碳循环的作用还不够了解,阻碍了碳汇渔业的发展。通过对鱼类碳来源的划分与贡献研究,可以更准确地计算海洋鱼类的碳摄入量,从而定量研究渔业的碳汇能力。
4 结论本研究表明,庙岛群岛毗邻海域秋季底栖食物网生物类群的潜在碳来源主要为藻类(浮游植物、大型藻类)和SOM,其中,藻类的贡献最大,POM的贡献较低。碳来源主要以内源性碳为主。通过对食物网碳来源贡献的研究,可以更准确地计算鱼类的碳摄入量,有助于进一步认识海洋生物碳汇的途径和过程,深入了解海–陆相互作用过程中的碳循环机制,促进制定更加合理的碳汇渔业管理策略。但食物网是一个动态复杂的过程,海洋生物的碳汇机制具有许多的不确定性,碳来源贡献只是一种相对简化的模型分析方法,分析结果受诸多因素的影响,存在许多不确定性,无法完全衡量复杂的碳来源机制,因此,本研究具有一定的参考性,但无典型代表性。在今后的研究中,应进一步优化碳来源的选择,在碳汇渔业理念的指导下,对食物网在海洋碳汇中的生物作用展开进一步的研究。
CAI D L, MENG F, HAN Y B, et al. Studies on 13C/12C ratios as a tracer for food web in a marine ecosystem: The trophic relations in pelagic food webs in Laoshan Bay. Oceanologia et Limnologia Sinica, 1999, 30(6): 671-678 [蔡德陵, 孟凡, 韩贻兵, 等. 13C/12C比值作为海洋生态系统食物网示踪剂的研究——崂山湾水体生物食物网的营养关系. 海洋与湖沼, 1999, 30(6): 671-678 DOI:10.3321/j.issn:0029-814X.1999.06.015] |
CHEN P Q. Earth system carbon cycle. Beijing: Science Press, 2004: 17-19 [陈泮勤. 地球系统碳循环. 北京: 科学出版社, 2004: 17-19]
|
CHI Y, SHI H H, WANG Y Y, et al. Evaluation on island ecological vulnerability and its spatial heterogeneity. Marine Pollution Bulletin, 2017, 125(1/2): 216-241 |
CURRIN C A, NEWELL S Y, PAERL H. The role of standing dead Spartina alterniflora and benthic microalgae in saltmarsh food webs: Considerations based on multiple stable isotope analysis. Marine Ecology Progress Series, 1995, 121(1/2/3): 99-116 |
DARNAUDE A M. Fish ecology and terrestrial carbon use in coastal areas: Implications for marine fish production. Journal of Animal Ecology, 2005, 74: 864-876 DOI:10.1111/j.1365-2656.2005.00978.x |
FENG Z H, MENG Y, LU W, et al. Studies on photosynthesis carbon fixation and ocean acidification prevention in Ulva prolifera Ⅰ. Rate of photosynthesis carbon fixation and seawater pH increase. Acta Oceanologica Sinica, 2012, 34(2): 162-168 [冯子慧, 孟阳, 陆巍, 等. 绿潮藻浒苔光合固碳与防治海水酸化的作用Ⅰ. 光合固碳与海水pH值提高速率研究. 海洋学报, 2012, 34(2): 162-168] |
Food and Agriculture Organization. State of the World's Fisheries and Aquaculture (2008). Roman, 2009 [联合国粮食与农业组织渔业及水产养殖部(FAO). 世界渔业和水产养殖状况(2008). 罗马, 2009]
|
GAO S K, SUN W, ZHANG S. The potential carbon source and trophic level analysis of main organisms in coastal water of Lüsi fishing ground, based on carbon and nitrogen stable isotope analysis. Haiyang Xuebao, 2021, 43(6): 71-80 [高世科, 孙文, 张硕. 基于稳定同位素方法的吕泗渔场近岸海域主要生物潜在碳源及营养级分析. 海洋学报, 2021, 43(6): 71-80] |
GILLIKIN P D, LORRAIN A, BOUILLON S, et al. Stable carbon isotopic composition of Mytilus edulis shells: Relation to metabolism, salinity, δ13CDIC and phytoplankton. Organic Geochemistry, 2006, 37(10): 1371-1382 DOI:10.1016/j.orggeochem.2006.03.008 |
HE P M, LIU Y Y, ZHANG J W, et al. Research progress on the effects of macroalgae on carbon sink. Journal of Fishery Sciences of China, 2015, 22(3): 588-595 [何培民, 刘媛媛, 张建伟, 等. 大型海藻碳汇效应研究进展. 中国水产科学, 2015, 22(3): 588-595] |
JIANG H B, TIAN X L, DONG S L, et al. The preliminary study on growth, chemical constituent and habitat of Sargassum thunbergii. Transactions of Oceanology and Limnology, 2009, 11061106(2): 59-66 [姜宏波, 田相利, 董双林, 等. 鼠尾藻生长、藻体成分及其生境的初步研究. 海洋湖沼通报, 2009, 11061106(2): 59-66 DOI:10.3969/j.issn.1003-6482.2009.02.009] |
JIAO N Z, LI C, WANG X X. Response and feedback of marine carbon sink to climate change. Advances in Earth Science, 2016, 31(7): 668-681 [焦念志, 李超, 王晓雪. 海洋碳汇对气候变化的响应与反馈. 地球科学进展, 2016, 31(7): 668-681] |
JIAO N Z, HERNDL G J, HANSELL D A, et al. Microbial production of recalcitrant dissolved organic matter: Long-term carbon storage in the global ocean. Nature Reviews Microbiology, 2010, 8(8): 593-599 DOI:10.1038/nrmicro2386 |
KANAYA G, TAKAGI S, NOBATA E, et al. Spatial dietary shift of macrozoo benthos in a brackish lagoon revealed by carbon and nitrogen stable isotope ratios. Marine Ecology Progress Series, 2007, 345: 117-127 DOI:10.3354/meps07025 |
KOHLBACH D, GRAEVE M, A., LANGE B, et al. The importance of ice algae-produced carbon in the central Arctic Ocean ecosystem: Food web relationships revealed by lipid and stable isotope analyses: Ice algal carbon in Arctic food web. Limnology and Oceanography, 2016, 61(6): 2027-2044 DOI:10.1002/lno.10351 |
LI J, GUAN C T. Preliminary analysis of carbon sink mechanism and potential of artificial reef ecosystem. Progress in Fishery Sciences, 2013, 34(1): 65-69 [李娇, 关长涛. 人工鱼礁生态系统碳汇机理及潜能分析. 渔业科学进展, 2013, 34(1): 65-69 DOI:10.3969/j.issn.1000-7075.2013.01.010] |
LI Y K, GONG Y. Food web structure of the East Lake Taihu by analysis of stable carbon and nitrogen isotopes. Chinese Journal of Ecology, 2014, 33(6): 1534-1538 [李云凯, 贡艺. 基于碳、氮稳定同位素技术的东太湖水生食物网结构. 生态学杂志, 2014, 33(6): 1534-1538] |
LIU H, TANG Q S. Review on worldwide study of ocean biological carbon sink. Journal of Fishery Sciences of China, 2011, 18(3): 695-702 [刘慧, 唐启升. 国际海洋生物碳汇研究进展. 中国水产科学, 2011, 18(3): 695-702] |
LIU J H, ZHANG F, JIAO N Z. Deciphering the mechanisms of carbon sink through a holistic view of interactions between land and ocean. Chinese Science Bulletin, 2015, 60(35): 3399-3405 [刘纪化, 张飞, 焦念志. 陆海统筹研发碳汇. 科学通报, 2015, 60(35): 3399-3405] |
LIU H X, XU J, LI C H, et al. Stable carbon isotope of zooplankton in the southern South China Sea. Journal of Tropical Oceanography, 2015a, 34(4): 59-64 [刘华雪, 徐军, 李纯厚, 等. 南海南部浮游动物稳定同位素研究——碳稳定同位素. 热带海洋学报, 2015a, 34(4): 59-64] |
LIU H X, XU J, LI C H, et al. Stable nitrogen isotope of zooplankton in the southern South China Sea. Journal of Tropical Oceanography, 2015b, 34(2): 32-38 [刘华雪, 徐军, 李纯厚, 等. 南海南部浮游动物稳定同位素研究——氮稳定同位素. 热带海洋学报, 2015b, 34(2): 32-38] |
LÜ W Q, CHEN A Q, LIU H. Carbonate deposits in marine fish intestines: contribution of marine fish cultures to carbon sink fisheries. Journal of Fisheries of China, 2012, 36(12): 1924-1932 [吕为群, 陈阿琴, 刘慧. 鱼类肠道的碳酸盐结晶物: 海水鱼类养殖在碳汇渔业中的地位和作用. 水产学报, 2012, 36(12): 1924-1932] |
MAGNI P, RAJAGOPAL S, VANDER V G, et al. Sediment features, macrozoobenthic assemblages and trophic relationships (delta13C and delta15N analysis) following a dystrophic event with anoxia and sulphide development in the Santa Giusta lagoon (western Sardinia, Italy). Marine Pollution Bulletin, 2008, 57(1/2/3/4/5): 125-136 |
MCINTYRE P B, FLECKER A S. Rapid turnover of tissue nitrogen of primary consumers in tropical freshwaters. Oecologia, 2006, 148: 12-21 DOI:10.1007/s00442-005-0354-3 |
MELILLO J M, CALLAGHAN T V, WOODWARD F I. Effects on ecosystems. HOUGHTON J T, JENKINS G J, EPHRAUMS J J. Climate change: The IPCC scientific assessment. Cambridge: Cambridge University Press, 1990, 283-310
|
METZ B, DAVIDSON O, SWART R, et al. Climate change 2001: Mitigation, contribution of working group Ⅲ to the third assessment report of the Intergovernmental Panel on Climate Change (IPCC). Cambridge: Cambridge University Press, 2001, 2
|
MILLS M M, ALDERKAMP A C, THURÓCZY C E, et al. Phytoplankton biomass and pigment responses to Fe amendments in the Pine Island and Amundsen polynyas. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2012, 71/72/73/74/75/76: 61-76
|
MIYATAKE T, MOERDIJK-POORTVLIET T C W, STAL L J, et al. Tracing carbon flow from microphytobenthos to major bacterial groups in an intertidal marine sediment by using an in situ 13C pulse-chase method. Limnology and Oceanography, 2014, 59(4): 1275-1287 DOI:10.4319/lo.2014.59.4.1275 |
NELLEMANN C, CORCORAN E, DUARTE C M, et al. Blue carbon: A rapid response assessment. United Nations Environment Programme, GRID-Arendal, 2009
|
POST D M, LAYMAN C A, ARRINGTON D A, et al. Getting to the fat of the matter: Models, methods and assumptions for dealing with lipids in stable isotope analyses. Oecologia, 2007, 152: 179-189 DOI:10.1007/s00442-006-0630-x |
POST D M. Using stable isotopes to estimate trophic position: Models, methods, and assumptions. Ecology, 2002, 83(3): 703-718 DOI:10.1890/0012-9658(2002)083[0703:USITET]2.0.CO;2 |
QU P, ZHANG Z, PANG M, et al. Stable isotope analysis of food sources sustaining the subtidal food web of the Yellow River estuary. Ecological Indicators, 2019, 101: 303-312 DOI:10.1016/j.ecolind.2019.01.021 |
SHEN C, SHI H H, ZHENG W, et al. Spatial heterogeneity of ecosystem health and its sensitivity to pressure in the waters of nearshore archipelago. Ecological Indicators, 2016, 61: 822-832 DOI:10.1016/j.ecolind.2015.10.035 |
SONG J M. Carbon sources and sinks in oceans. Marine Environmental Science, 2003, 22(2): 75-80 [宋金明. 海洋碳的源与汇. 海洋环境科学, 2003, 22(2): 75-80 DOI:10.3969/j.issn.1007-6336.2003.02.019] |
SUN J. Marine phytoplankton and biological carbon sink. Acta Oceanologica Sinica, 2011, 31(18): 5372-5378 [孙军. 海洋浮游植物与生物碳汇. 生态学报, 2011, 31(18): 5372-5378] |
SUN J. Organic carbon pump and carbonate counter pump of living Coccolithophorid. Advances in Earth Science, 2007, 22(12): 1231-1239 [孙军. 今生颗石藻的有机碳泵和碳酸盐反向泵. 地球科学进展, 2007, 22(12): 1231-1239 DOI:10.3321/j.issn:1001-8166.2007.12.003] |
TANG Q S. Carbon sink fishery and mariculture: Strategic emerging industry. China Fishery News, 2010-11-29(007) [唐启升. 碳汇渔业与海水养殖业——战略性新兴产业. 中国渔业报, 2010-11-29(007)]
|
VIZZINI S, MAZZOLA A. Seasonal variations in the stable carbon and nitrogen isotope ratios (13C/12C and 15N/14N) of primary producers and consumers in a western Mediterranean coastal lagoon. Marine Biology, 2003, 142(5): 1009-1018 DOI:10.1007/s00227-003-1027-6 |
WANG S H. Carbon sink phytoplankton in Bohai and Yellow Sea. Masterxs Thesis of Shandong University, 2019 [王世浩. 黄渤海浮游植物碳汇研究. 山东大学硕士研究生学位论文, 2019]
|
WEI H J, ZHU X M, JI Y N, et al. Study on the food web structure and their trophic levels of marine ranching area in Xiangshan Harbor. Journal of Applied Oceanography, 2013, 32(2): 250-257 [魏虎进, 朱小明, 纪雅宁, 等. 基于稳定同位素技术的象山港海洋牧场区食物网基础与营养级的研究. 应用海洋学学报, 2013, 32(2): 250-257 DOI:10.3969/J.ISSN.2095-4972.2013.02.015] |
WEITERE M, SCHERWASS A, SIEBEN K T, et al. Planktonic food web structure and potential carbon flow in the lower river rhine with a focus on the role of protozoans. River Research and Applications, 2005, 21(5): 535-549 DOI:10.1002/rra.825 |
XIE B, HUANG C, WANG Y, et al. Trophic gauntlet effects on fisheries recovery: A case study in Sansha Bay, China. Ecosystem Health and Sustainability, 2021, 7(1): 1965035 DOI:10.1080/20964129.2021.1965035 |
XIE B, LI Y K, ZHANG H, et al. Food web foundation and seasonal variation of trophic structure based on the stable isotopic technique in the marine ranching of Haizhou Bay, China. Chinese Journal of Applied Ecology, 2017, 28(7): 2292-2298 [谢斌, 李云凯, 张虎, 等. 基于稳定同位素技术的海州湾海洋牧场食物网基础及营养结构的季节性变化. 应用生态学报, 2017, 28(7): 2292-2298] |
ZHAO X W. Carbon sink of phytoplankton and fecal pellets in Bohai and Yellow Sea. Masterxs Thesis of Shandong University, 2020 [赵相伟. 黄渤海浮游植物及粪便颗粒物碳汇研究. 山东大学硕士研究生学位论文, 2020]
|
ZHENG Y Y. Effects of food resource availability and hydrological variation on autochthonous and allochthonous carbon in the Irtysh River (Xinjiang). Masterxs Thesis of Huazhong Agricultural University, 2018 [郑圆圆. 食物资源可利用性与水文变化对新疆额尔齐斯河食物网内/外源碳利用的影响. 华中农业大学硕士研究生学位论文, 2018]
|
ZHU H. Mechanism of advancement from carbon sink fisheries to blue granary. Journal of Shanghai Ocean University, 2019, 28(6): 968-975 [朱骅. 从碳汇渔业到蓝色粮仓的发展机制. 上海海洋大学学报, 2019, 28(6): 968-975] |



